题目内容
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是
A.Na+ B.Fe3+ C.Al3+ D.Fe2+
D
【解析】
试题分析:Na+ 不参与反应,数目不会减少,A错;FeCl3与NaOH溶液反应生成Fe(OH)3,Fe(OH)3又与盐酸反应生成FeCl3,所以离子数目没有减少,B错;AlCl3与NaOH溶液反应生成NaAlO2,又和盐酸反应生成AlCl3、Al3+ 不会减少,C错;FeCl2和NaOH溶液反应生成Fe(OH)2,溶液被氧气氧化成Fe(OH)3。再加盐酸反应生成FeCl3,Fe2+转变成Fe3+,Fe2+ 数目较少了,D对
考点:物质的化学性质。

 阅读快车系列答案
阅读快车系列答案(14分)某学生用0.1000 mol·L-1的NaOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准NaOH溶液注入碱式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)______________________________。
(2)上述B步骤操作的目的是_______________________________________。
(3)实验中用左手控制活塞,眼睛注视 ___________________,直至滴定终点。判断到达终点的现象是________________________________。
(4)某学生根据3次实验分别记录有关数据如下表:
滴定 次数 | 待测溶液的体积(mL) | 0.100 0 mol·L-1NaOH的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积(mL) | ||
第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该盐酸溶液的物质的量浓度为
(5)用0.1000 mol·L-1 NaOH溶液滴定0.1000 mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH等于____________
(6)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶中溶液的颜色刚刚由无色变为浅红色即停止滴定
B.碱式滴定管用蒸馏水洗净后立即注入标准液
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
E.实验中,用待盛装的溶液润洗锥形瓶
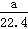 NA
NA


 B.
B.
 D.
D.
