题目内容
20.设NA为阿伏伽德罗常数的数值,则下列说法中正确的是( )| A. | 过氧化钠与水反应,若电子转移4NA,则产生的氧气为32g | |
| B. | 标准状况下,22.4L空气中含有NA个分子 | |
| C. | 4g乙烯与丙烯的混合气体含有0.15NA个碳原子 | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
分析 A.过氧化钠中氧元素的化合价为-1价,过氧化钠与水反应生成1mol氧气转移2mol电子;
B.标准状况下1mol任何气体的体积约为22.4L;
C.乙烯和丙烯的最简式均为CH2;
D.铜只能与浓硫酸反应,与稀硫酸不反应.
解答 解:A.过氧化钠与水反应,转移的电子为2mol,则生成氧气的物质的量为1mol,若电子转移4NA,产生的氧气物质的量为2mol,氧气的质量为64g,故A错误;
B.标准状况下,22.4L空气中含有分子数=$\frac{22.4L}{22.4L/mol}$×NA=NA个,故B正确;
C.乙烯和丙烯的最简式均为CH2,故1.4g混合物中含有的CH2的物质的量为1.4÷14=0.1mol,故含0.1NA个碳原子,故C错误;
D.铜只能与浓硫酸反应,与稀硫酸不反应,故硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析判断,主要是气体摩尔体积的条件应用、氧化还原反应电子转移的分析和浓硫酸变为稀硫酸不与铜继续反应、微粒数的计算应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
9.下列氧化物能与铝粉组成铝热剂的是( )
| A. | MgO | B. | Fe2O3 | C. | Na2O | D. | CaO |
11.下列叙述正确的是( )
| A. | 1 mol CH4与4 mol Cl2在光照下反应可生成1 mol CCl4 | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 现有乙烯、丙烯的混合气体共14g,其原子数为3NA | |
| D. | 1 mol乙烷和丙烷的混合物,完全燃烧生成3 mol H2O |
8.下列有关化学用语表示正确的是( )
| A. | 冰晶石的化学式:Na3AlF6 | |
| B. | 羟基的电子式: | |
| C. | 磷酸的电离方程式:H3PO4?3H++PO43- | |
| D. | 聚丙烯的结构简式: |
5.下列叙述中,正确的是( )
| A. | 具有规则几何外形的固体一定是晶体 | |
| B. | 晶体与非晶体的根本区别在于是否具有规则的几何外形 | |
| C. | 晶体、非晶体具有固定的熔点 | |
| D. | 具有各向异性的固体一定是晶体 |
4.a 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
(滴定时,1mol (CH2)6N4H+与1mol H+相当),然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①选用滴定管为乙(填“甲”或“乙”).

②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”);锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1010mo1•L-1,则该样品中氮的质量分数为18.85%.
b 在测定中和热的实验中,下列说法正确的是A
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计.
(滴定时,1mol (CH2)6N4H+与1mol H+相当),然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①选用滴定管为乙(填“甲”或“乙”).

②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”);锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
b 在测定中和热的实验中,下列说法正确的是A
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计.
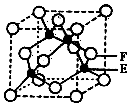 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:
 .
. .
.
 .
.