题目内容
7.常温下,下列溶液中各微粒浓度关系正确的是( )| A. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>②>③ | |
| B. | 向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)=c(SO42-)>c(OH-)=c(H+) | |
| C. | 向1L0.1 mol/L的NaOH溶液中通入6.6gCO2:2c(Na+)=3[c(CO32?)+c(HCO3?)+c(H2CO3)] | |
| D. | CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
分析 A.对应酸的酸性越弱,酸根离子的水解程度越强,溶液的pH越大,已知酸性c(CH3COOH)>c(H2CO3)>c(C6H5OH),据此判断pH相同的CH3COONa溶液、C6H5ONa溶液、NaHCO3溶液的浓度关系;
B.溶液为中性时c(OH-)=c(H+),根据电荷守恒可知c(NH4+)=2c(SO42-);
C.6.6g二氧化碳的物质的量为:$\frac{6.6g}{44g/mol}$=0.15mol,1L0.1 mol/L的NaOH溶液中含有氢氧化钠的物质的量为:0.1mol/L×1L=0.1mol,0.1mol氢氧化钠溶液最多消耗0.1mol二氧化碳,说明二氧化碳过量,反应生成碳酸氢钠,根据碳酸氢钠溶液中的物料守恒判断;
D.溶液中一定满足电荷守恒,根据混合液中的电荷守恒判断.
解答 解:A.已知酸性c(CH3COOH)>c(H2CO3)>c(C6H5OH),则等浓度的CH3COONa溶液、C6H5ONa溶液、NaHCO3溶液的pH大小为:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa),则pH相同的CH3COONa溶液、C6H5ONa溶液、NaHCO3溶液的浓度关系为:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa),即,①>③>②,故A错误;
B.向氨水中滴加稀硫酸至溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知c(NH4+)=2c(SO42-),溶液中离子浓度大小为:c(NH4+)=2c(SO42-)>c(OH-)=c(H+),故B错误;
C.向1L0.1 mol/L的NaOH溶液中通入6.6gCO2,6.6g二氧化碳的物质的量为:$\frac{6.6g}{44g/mol}$=0.15mol,1L0.1 mol/L的NaOH溶液中含有氢氧化钠的物质的量为:0.1mol/L×1L=0.1mol,根据反应OH-+CO2=NaHCO3可知,二氧化碳过量,反应后溶质为碳酸氢钠,根据NaHCO3中的物料守恒可得:c(Na+)=c(CO32?)+c(HCO3?)+c(H2CO3),故C错误;
D.CH3COONa溶液中加入少量KNO3后的碱性溶液,溶液中一定满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒的含义为解答关键,C为易错点,注意根据反应物的物质的量正确判断反应产物,试题培养了学生的分析、理解能力及灵活应用能力.

 优生乐园系列答案
优生乐园系列答案①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
 ⑧
⑧
| A. | ①②③ | B. | ④⑥⑧ | C. | ④⑧ | D. | ⑤⑦⑧ |
| A. | 乙醇的作用是为了在微热下溶解牛油 | |
| B. | 加入氢氧化钠溶液,边搅拌边小心加热,反应液逐渐变成黄棕色黏稠状 | |
| C. | 蘸取反应液,滴入热水中,若无油滴浮在液面上说明已完全反应 | |
| D. | 完全反应后,加入热的饱和食盐水,有固体析出,固体沉于液面下 |
| A. | 向氨水中通入足量二氧化碳:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 铜片与浓硝酸反应:Cu+NO3-+4H+═Cu2++NO2↑+2H2O | |
| C. | 氯化铵浓溶液跟NaOH浓溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 84消毒液具有消毒性的原理为:2ClO-+CO2+H2O=2HClO+CO32- |
| A. | 醋酸溶液 | B. | 豆浆 | C. | 氢氧化铁沉淀 | D. | 蔗糖 |
| A. |  石油分馏 | B. |  灼烧干海带 | ||
| C. |  用CCl4萃取碘水中的碘 | D. |  治炼金属铁 |
| A. | NaCl Na2CO3 NH4Cl NaHSO4 | |
| B. | NaHSO4 NH4Cl NaCl Na2CO3 | |
| C. | NH4Cl NaHSO4 NaCl Na2CO3 | |
| D. | Na2CO3 NaCl NH4Cl NaHSO4 |
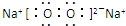 .
.