题目内容
17.下列盐的水溶液,pH按由小到大顺序排列的是( )| A. | NaCl Na2CO3 NH4Cl NaHSO4 | |
| B. | NaHSO4 NH4Cl NaCl Na2CO3 | |
| C. | NH4Cl NaHSO4 NaCl Na2CO3 | |
| D. | Na2CO3 NaCl NH4Cl NaHSO4 |
分析 根据溶液的酸碱性以及利用盐类的水解程度来确定溶液中pH大小,酸的酸性越弱则酸的酸根离子水解程度越大,其相同浓度钠盐溶液的pH越大.
解答 解:NaHSO4在水溶液中完全电离出氢离子,NH4Cl中铵根离子水解导致溶液显示酸性,但是酸性小于硫酸氢钠,CH3COONa、Na2CO3是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱水解程度越大,溶液中氢氧根离子浓度越大,pH越大,酸根离子的水解程度大小为CH3COO-<CO32-,所以溶液pH:CH3COONa<Na2CO3,按pH由小到大的顺序排列为:NaHSO4<NH4Cl<CH3COONa<Na2CO3,
故选B.
点评 本题考查了溶液pH的大小比较方法应用,主要是离子水解的应用,酸越弱,阴离子水解程度越大.

练习册系列答案
相关题目
7.常温下,下列溶液中各微粒浓度关系正确的是( )
| A. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>②>③ | |
| B. | 向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)=c(SO42-)>c(OH-)=c(H+) | |
| C. | 向1L0.1 mol/L的NaOH溶液中通入6.6gCO2:2c(Na+)=3[c(CO32?)+c(HCO3?)+c(H2CO3)] | |
| D. | CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
8.可鉴别出甲酸、乙酸、甲酸乙酯、乙酸乙酯四种物质的试剂是( )
| A. | 溴水 | B. | NaOH溶液 | C. | 饱和Na2CO3溶液 | D. | 新制Cu(OH)2悬浊液 |
5.下列说法正确的是( )
| A. | 化学实验产生的废液应及时倒入下水道 | |
| B. | 实验室的废酸或废碱可用中和法来处理 | |
| C. | 实验用剩的钾、钠等金属要即时扔进废液缸 | |
| D. | 如果酸洒在实验桌上,立即用氢氧化钠溶液中和 |
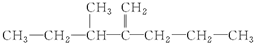 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯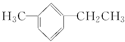 ,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.
,可命名为1-甲基-3-乙基苯(或3-甲基乙苯或间甲基乙苯);.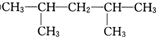
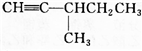 .
.