题目内容
16.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和.(1)A为C,B为O,C为Na(填元素符号).
(2)E的电子式为
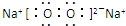 .
.(3)B、C、D简单离子的半径由大到小的顺序为S2->O2->Na+(填离子符号).
(4)B和D非金属性较强的是O(填元素符号).
(5)写出D的最高价氧化物的水化物和A单质反应的化学方程式2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+2H2O.
分析 因B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,可知E为过氧化钠,B为氧元素,C为钠元素;D的L层电子数等于K、M两个电子层上的电子数之和,所以K、L、M三个电子层上的电子数分别为2、8、6,可知D为硫元素;A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子,可知A为碳元素,据此分析解答.
解答 解:因B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,可知E为过氧化钠,B为氧元素,C为钠元素;D的L层电子数等于K、M两个电子层上的电子数之和,所以K、L、M三个电子层上的电子数分别为2、8、6,可知D为硫元素;A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子,可知A为碳元素,
(1)因A为碳,B为氧元素,C为钠元素,D为硫元素,
故答案为:C;O;Na;
(2)E为过氧化钠,过氧化钠为离子化合物,过氧化钠中含有钠离子和过氧根离子形成的离子键和氧与氧之间形成的共价键,
故答案为: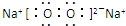 ;
;
(3)电子层数越多半径越大,相同电子层数,原子序数越小半径越大,B、C、D简单离子的半径由大到小的顺序为S2->O2->Na+,
故答案为:S2->O2->Na+;
(4)同主族从上到下,元素的非金属性逐渐减弱,非金属性O>S,
故答案为:O;
(5)D的最高价氧化物的水化物为硫酸,A单质为碳,两者在加热的条件下发生反应生成二氧化硫、二氧化碳和水,
故答案为:2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+CO2↑+2H2O.
点评 本题是根据原子结构及部分物质性质推断元素种类,书写电子式、半径大小比较、化学方程式等化学用语,要求学生熟悉元素周期表及周期律,难度不大.

| A. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>②>③ | |
| B. | 向氨水中滴加稀硫酸至溶液呈中性:c(NH4+)=c(SO42-)>c(OH-)=c(H+) | |
| C. | 向1L0.1 mol/L的NaOH溶液中通入6.6gCO2:2c(Na+)=3[c(CO32?)+c(HCO3?)+c(H2CO3)] | |
| D. | CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| A. | 符合同一通式的有机物一定互为同系物 | |
| B. | 乙烷不能使溴水和高锰酸钾酸性溶液褪色 | |
| C. | 所有的有机物都很容易燃烧 | |
| D. | 易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲基的电子式: | ||
| C. | 乙醇的分子式:C2H5OH | D. | 二氧化碳的电子式: |
| A. | 溴水 | B. | NaOH溶液 | C. | 饱和Na2CO3溶液 | D. | 新制Cu(OH)2悬浊液 |
| A. | 化学实验产生的废液应及时倒入下水道 | |
| B. | 实验室的废酸或废碱可用中和法来处理 | |
| C. | 实验用剩的钾、钠等金属要即时扔进废液缸 | |
| D. | 如果酸洒在实验桌上,立即用氢氧化钠溶液中和 |

 金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得到迅猛发展.
金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得到迅猛发展.