题目内容
同温同压下,等质量的下列各组气体含有相同数目的原子数的是( )
| A、O2与O3 |
| B、SO2与SO3 |
| C、CO2与CO |
| D、CO与N2 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:同温同压下,气体摩尔体积相等,根据N=
NA计算其分子个数,再结合分子构成计算其原子个数.
| m |
| M |
解答:
解:同温同压下,气体摩尔体积相等,
A.相同质量的O2与O3,氧气和臭氧中摩尔质量之比为2:3,氧气分子和臭氧分子中原子个数之比为2:3,所以氧气和臭氧总的原子个数相等,故A正确;
B.根据N=
NA知,相同质量的二氧化硫和三氧化硫,其物质的量之比等于其摩尔质量反比=80g/mol:64g/mol=5:4,根据分子构成知,其原子个数之比=(5×3):(4×4)=15:16,故B错误;
C.根据N=
NA知,相同质量的二氧化硫和CO,其物质的量之比等于其摩尔质量反比=44g/mol:28g/mol=11:7,根据分子构成知,其原子个数之比=(11×3):(7×2)=33:14,故C错误;
D.根据N=
NA知,相同质量的CO和氮气,其物质的量之比等于其摩尔质量反比=28g/mol:28g/mol=1:1,根据分子构成知,其原子个数之比=(1×2):(1×2)=1:1,故D正确;
故选AD.
A.相同质量的O2与O3,氧气和臭氧中摩尔质量之比为2:3,氧气分子和臭氧分子中原子个数之比为2:3,所以氧气和臭氧总的原子个数相等,故A正确;
B.根据N=
| m |
| M |
C.根据N=
| m |
| M |
D.根据N=
| m |
| M |
故选AD.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,注意A中计算方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将1mol A和3mol B充入V L某密闭容器内发生反应:A(g)+B(g)?3C(g),2min时,c(A)=0.6mol?L-1,平均反应速率v(C)=0.6mol?L-1?min-1,则该容器的体积V的值为( )
| A、0.2 | B、0.5 | C、1 | D、2 |
下列有关物质结构的表述正确的是( )
A、次氯酸的电子式 |
B、硅原子价电子排布图为 |
| C、硫离子的最外层电子排布式3s23p4 |
D、钠离子的结构示意图: |
下列说法正确的是( )
| A、同温同压下甲烷和氧气的密度之比2:1 |
| B、1g甲烷和1g 氧气的原子数之比为5:1 |
| C、等物质的量的甲烷和氧气的质量之比2:1 |
| D、等质量的甲烷和氧气的体积之比为2:1 |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、常温常压下,3.0 g乙烷中含有的碳氢键数为0.7NA |
| B、将0.2 mol FeCl3水解制成胶体,所得胶体粒子数为 0.2NA |
| C、常温常压下,28 g的 C2H4和C3H6混合气体含有的原子数为 6NA |
| D、标准状况下,由Na2O2制得11.2 L O2,反应转移的电子数为0.5NA |



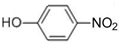 ⑥
⑥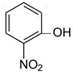 ⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl
⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl