题目内容
16.某实验小组依据反应AsO43-+2H++2I-?AsO33-+I2+H2O设计如图1,电池,探究pH对AsO43-氧化性的影响,测得输出电压与pH的关系如图2.下列有关叙述错误的是( )
| A. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | a点时,盐桥中K+向左移动 | |
| D. | pH>0.68时,氧化性I2>AsO43- |
分析 A、pH=5时,电压小于0,反应逆向进行,AsO33-在负极失电子;
B、pH=0.68时,电压为零;
C、原电池中阳离子向正极移动;
D、pH>0.68时,电压小于0,反应逆向进行.
解答 解:A、pH=5时,电压小于0,反应逆向进行,AsO33-在负极失电子,则负极电极反应式为AsO33--2e-+H2O=AsO43-+2H+,故A错误;
B、pH=0.68时,电压为零,反应处于平衡状态,故B正确;
C、乙中碘离子失电子,则乙中石墨电极为负极,甲中石墨为正极,原电池中阳离子向正极移动,所以盐桥中K+向左移动,故C正确;
D、pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43-,故D正确.
故选A.
点评 本题考查了原电池原理的应用和化学平衡移动,侧重于知识的综合应用的考查,难度中等,注意把握题目图象中所给出的信息,考查了学生的读图能力和对基础知识的应用能力.

练习册系列答案
相关题目
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA | |
| B. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| C. | 1mol Cu分别与足量的Cl2和S反应,转移电子数均为2NA | |
| D. | 1mol•L-1 FeCl3溶液中含有的Fe3+数目小于NA |
1.化学与科学、技术、社会和环境密切相关.下列有关说法正确的是( )
| A. | 煤的气化和液化是物理变化,煤的干馏是化学变化 | |
| B. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 | |
| C. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | |
| D. | 合成氨反应N2(g)+3H2(g)?2NH3(g) OH<O,加入催化剂能加快反应速率并提高转化率 |
 有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.
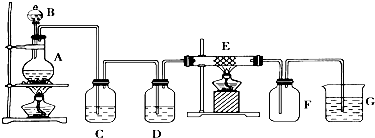
有关物质的转化关系如图所示(部分物质与条件己略去).A中只含两种元素且质量比为7:8,B和C为无色气体单质,D是一种能导致酸雨的有害气体,E为红棕色固体,F为最常见的液体,G为黄绿色气体,J在H的浓溶液中会发生钝化.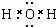 .
.
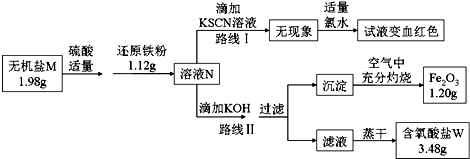
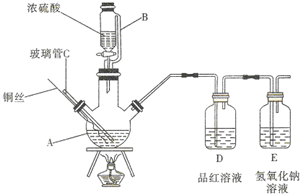 如图为某实验小组同学设计的铜与浓硫酸反应的实验装置,实验步骤如下:
如图为某实验小组同学设计的铜与浓硫酸反应的实验装置,实验步骤如下: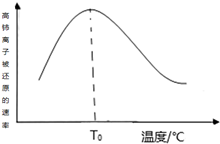 高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响.
高铈离子被还原的速率与温度的关系如图所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是高铈离子被还原的反应,正反应为放热反应,开始反应时,反应物浓度大,反应速率快,正反应为放热反应,温度逐渐升高,反应速率加快,温度高于T0℃时,反应物的浓度减少,反应速率减小,温度对反应速率的影响不及浓度的影响. .
.