题目内容
15.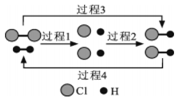 H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列属于吸热过程的是 ( )
H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列属于吸热过程的是 ( )| A. | 过程 1 | B. | 过程 2 | C. | 过程 3 | D. | 过程 4 |
分析 氯气与氢气的燃烧为放热反应,化学键旧键断裂为吸热过程,新键的形成过程为放热过程,据此进行解答.
解答 解:根据图示可知,过程1为HH、Cl-Cl键断裂形成H、Cl原子,为吸热过程;
过程2为H-Cl键的形成过程,该过程放热;
过程3为H2与Cl2燃烧生成HCl,为放热反应;
过程4为HCl分解生成氢气和氯气,为吸热反应;
根据分析可知,属于吸热过程的是:过程1和过程4,
故选AD.
点评 本题考查反应热与焓变的应用,题目难度中等,从宏观、微观角度理解化学反应与能力变化的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3. (1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(2)基态磷原子核外有15种运动状态不同的电子.
(3)CO的结构可表示为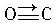 与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
则KCl、MgO、CaO三种晶体的熔点从高到低的顺序是MgO>CaO>KCl.其中MgO晶体中一个Mg2+周围和它最近且等距离的Mg2+有12个.
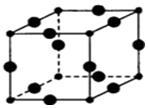
(5)Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示)
 (1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.
(1)某元素原子的价电子构型为4s24p1,它属于第四周期ⅢA族,属p区元素.(2)基态磷原子核外有15种运动状态不同的电子.
(3)CO的结构可表示为
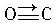 与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).
与CO结构最相似的分子是N2,这两种结构相似的分子中,分子的极性不相同(填“相同”或“不相同”).(4)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体的结构相似,已知NaCl、KCl、CaO晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3 401 |
(5)Cu3N的晶胞结构如图,N3-的配位数为6,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为$\frac{103}{4{N}_{A}(a+b)^{3}}$g•cm-3.(阿伏加德罗常数用NA表示)
10.下列各组物质,不能按右图(“→”表示反应一步完成)关系转化的是( )
| 选项 | a | b | c |  |
| A | Al | Al2O3 | Al (OH)3 | |
| B | SiO2 | Na2SiO3 | H2SiO3 | |
| C | AlCl3 | Na[Al(OH)4] | Al(OH)3 | |
| D | CaO | Ca(OH)2 | CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
4.一定量的甲烷燃烧后得到的产物为二氧化碳、一氧化碳和水蒸气,将产生的气体按顺序通过装有无水氯化钙和氢氧化钠的硬质玻璃管,氢氧化钠管的质量增加了4.4g,则甲烷在标准状况下的体积是多少,无水氯化钙的质量增加了 ( )
| A. | 0.56L 1.8g | B. | 1.12L 3.6g | C. | 2.24L 1.8g | D. | 2.24L 3.6g |
8.下列关于有机化合物的说法正确的是( )
| A. | 正丁烷与2-甲基丁烷互为同分异构体 | |
| B. | 聚乙烯能使溴的四氯化碳溶液褪色,发生的反应是加成反应 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,但在FeBr3存在下能与液溴发生取代反应 | |
| D. | 除去乙酸乙酯中残留的乙酸,有效的处理方法是水洗后分液 |
 (1)肼(N2H4)又称联氨,是一种可燃性液体,可用作燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,反应生成一种可以参与大气循环的气体.该电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑.
(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,反应生成一种可以参与大气循环的气体.该电池放电时,负极的电极反应式是:N2H4+4OH--4e-=4H2O+N2↑.
 .
.

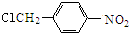 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$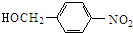 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$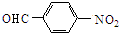 .
.