题目内容
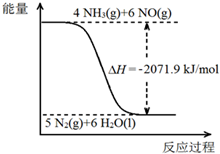
10.NH3可消除NO的污染,反应化学方程式为6NO+4NH3=5N2+6H2O.现有NH3和NO的混合物1mol 充分反应,若还原产物比氧化产物多1.4g.则下列判断正确的是( )| A. | 生成N2为5.6L | |
| B. | 有0.3mol NO 被还原 | |
| C. | 生成氧化产物4.2g | |
| D. | 原混合物中NO 和NH3的物质的量之比可能为3:22 |
分析 反应的方程式为:6NO+4NH3=5N2+6H2O,反应中NO中N元素的化合价由+2价降低到0价,得电子,NH3中N元素的化合价由-3价升高到0价,失电子,根据化学方程式以及经还原得到的N2比经氧化得到的N2多1.4g,利用讨论法计算原反应混合物中NO与NH3的物质的量.
解答 解:6molNO还原得到3molN2,4molNH3氧化得到2molN2,两者相差1molN2,现相差1.4g,$\frac{1.4g}{28g/mol}$=0.05mol,
相当于0.3molNO和0.2molNH3反应,
依题意NO和NH3的总物质的量为1mol,其中必有一种为过量,
所以有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO.
A.如是标准状况下,则V(N2)=0.25mol×22.4L/mol=5.6L,但气体存在的条件未知,不能确定气体的体积,故A错误;
B.由以上分析可知,有0.3 mol NO被还原,故B正确;
C.0.2molNH3反应,被氧化生成氮气,则氧化产物为0.1mol,质量为2.8 g,故C错误;
D.气体有两种情况:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO,二者比值不是3:2,故D错误.
故选B.
点评 本题考查氧化还原反应以及有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意根据化学方程式判断被氧化和被还原的物质的量的关系为解答该题的关键.

练习册系列答案
相关题目
20.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol固体氯化氨中存在离子数小于2NA | |
| B. | 标准状况下,22.4L己烷中共价键的数目为19NA | |
| C. | 标况下的NO2气体22.4L,其中含有的氮原子数为NA | |
| D. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
1.NaH与水反应的化学方程式为NaH+H2O═NaOH+H2↑,对该反应叙述中正确的是( )
| A. | 该反应属于置换反应 | |
| B. | NaH中的H为+1价 | |
| C. | 氧化剂是H2O | |
| D. | 每摩尔NaH参加反应时电子转移数为1e- |
5.下列变化需要加入还原剂的是( )
| A. | N2O5→HNO3 | B. | Cl-→ClO3- | C. | MnO2→Mn2+ | D. | H2→H2O |
2.化学与环境密切相关,下列有关说法正确的是( )
| A. | CO2属于大气污染物 | B. | 酸雨是PH小于7的雨水 | ||
| C. | CO2、NO2或SO2都会导致酸雨的形成 | D. | NO2造成光化学烟雾的主要因素 |
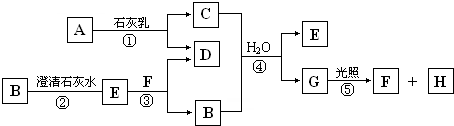
 .
. 尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.