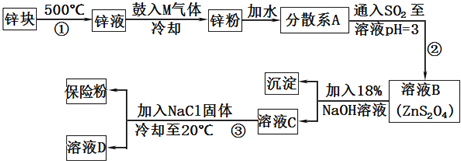
题目内容
13.下列叙述正确的是( )| A. | CO2的电子式为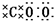 | |
| B. | 所有的主族元素的简单离子的化合价与其族序数相等 | |
| C. | NH4Cl晶体中,既含有离子键,又含有共价键 | |
| D. | 下列物质均为极性分子:H2O、NH3、CCl4 |
分析 A.二氧化碳形成的是碳氧双键;
B.一般来说最高正价与族序数相同,但阴离子不同;
C.NH4Cl晶体中,既含有离子键,又含有共价键;
D.CCl4为非极性分子.
解答 解:A.二氧化碳形成的是碳氧双键,共用两对电子对,故A错误;
B.主族元素形成的简单阴离子的化合价与族序数不等,故B错误;
C.NH4Cl晶体中,既含有铵根与氯离子间的离子键,又含有氮原子与氢原子间的共价键,故C正确;
D.CCl4为非极性分子,故D错误.
故选C.
点评 本题考查较为综合,侧重于元素周期表与周期律、化学键、分子的极性等知识的考查,周期表与周期律的关系及利用,题目难度中等,注意把握元素周期表的结构特点.

练习册系列答案
相关题目
3.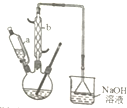 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:

实验步骤如下:
Ⅰ.在三颈烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗a中盛放有5.4mL环己醇.
Ⅱ.水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三颈烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)装置中仪器b的名称为球形冷凝管,使用时要从下口(填“上口”或“下口”)通入冷水.滴液漏斗的细支管a的作用是平衡滴液漏斗与圆底烧瓶内压强,便于环己醇顺利流下.
(2)本实验所用50%的硝酸物质的量浓度为10.4mol/L;实验中,氮氧化物废气(主要成分为NO2和NO)可以用NaOH溶液来吸收,其主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O
其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2;NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三颈烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三颈烧瓶置于冰水浴中.
(4)为了除去可能的杂质和减少产品损失,可依次用冰水和苯洗涤晶体.
 己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
Ⅰ.在三颈烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗a中盛放有5.4mL环己醇.
Ⅱ.水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三颈烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)装置中仪器b的名称为球形冷凝管,使用时要从下口(填“上口”或“下口”)通入冷水.滴液漏斗的细支管a的作用是平衡滴液漏斗与圆底烧瓶内压强,便于环己醇顺利流下.
(2)本实验所用50%的硝酸物质的量浓度为10.4mol/L;实验中,氮氧化物废气(主要成分为NO2和NO)可以用NaOH溶液来吸收,其主要反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O
其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的两个方程式:2NO2+Na2CO3=NaNO2+NaNO3+CO2;NO+NO2+Na2CO3=2NaNO2+CO2.
(3)向三颈烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三颈烧瓶置于冰水浴中.
(4)为了除去可能的杂质和减少产品损失,可依次用冰水和苯洗涤晶体.
4.下列设计的实验方案能达到实验目的是( )
| A. | 检验蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 | |
| B. | 检验溶液中是否含有NH4+:取少量待检验溶液,向其中加入浓NaOH溶液加热,再用湿润的红色石蕊试纸放置试管口,观察现象 | |
| C. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯加入过量浓溴水,振荡后静置过滤,除去三溴苯酚沉淀 | |
| D. | 浸有KMnO4(H+)溶液的滤纸中滴加SO2水溶液,滤纸褪色,说明SO2具有漂白性 |
8.下列说法正确的是( )
| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的沸点依次逐渐升高 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐增强 |
18.同周期的X、Y、Z三种元素,已知非金属性X>Y>Z,则下列判断正确的是( )
| A. | 原子半径X>Y>Z | |
| B. | 最高价氧化物的水化物酸性从强到弱的顺序是HXO4>H2YO4>H3ZO4 | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 阴离子的氧化性按Z、Y、X顺序由强到弱 |
5.下列关于周期表中第三周期元素性质从左到右变化趋势的叙述,错误的是( )
| A. | 最高正价依次升高 | |
| B. | 气态氢化物稳定性逐渐增强 | |
| C. | 原子半径逐渐增大 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强 |