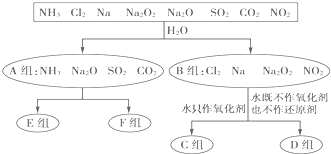
题目内容
现将一定量的高锰酸钾固体加热,完全分解后生成amolO2 ;然后再在剩余固体中加入足量浓盐酸并加热反应,含锰元素的化合物跟氯化氢发生氧化还原反应生成氯气bmol,反应后锰元素都呈+2价,求生成氧气与氯气的物质的量之比.
考点:化学方程式的有关计算
专题:
分析:根据题意2KMnO4=K2MnO4+MnO2 +O2↑ 完全分解,后来因反应后锰元素都呈+2价,发生K2MnO4+MnO2 +12HCl=2MnCl2+3Cl2↑+2KCl+6H2O 这个反应,设高锰酸钾为2mol,然后根据氧化还原反应方程式列出氧气与氯气物质的量的关系,最后得出结论.
解答:
解:2KMnO4=K2MnO4+MnO2 +O2↑…(1)
K2MnO4+MnO2 +12HCl=2MnCl2+3Cl2↑+2KCl+6H2O…(2)
由(1)、(2)得知反应中物质的量关系为:
KMnO4 :O2:Cl2=2:1:3
所以生成氧气和氯气的物质的量之比为:
O2:Cl2 =a:b=1:3
答:生成氧气与氯气的物质的量之比1:3.
K2MnO4+MnO2 +12HCl=2MnCl2+3Cl2↑+2KCl+6H2O…(2)
由(1)、(2)得知反应中物质的量关系为:
KMnO4 :O2:Cl2=2:1:3
所以生成氧气和氯气的物质的量之比为:
O2:Cl2 =a:b=1:3
答:生成氧气与氯气的物质的量之比1:3.
点评:本题考查混合物计算,难度中等,注意利用电子转移守恒解答,也可以利用方程式计算,但相对比较繁琐.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
下列两种物质发生反应:①Na和O2 ②AlCl3与氨水 ③漂白粉溶液与CO2 ④Fe与Cl2 ⑤Cu和HNO3,因反应物用量或反应条件的不同而生成不同产物的是( )
| A、①②③④⑤ | B、①②③⑤ |
| C、①②⑤ | D、①③⑤ |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、Na2O2与足量H2O反应,共生成2.24LO2,转移电子的数目为0.2NA |
| B、1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA |
| C、标准状况下,2.24 L己烷含有分子的数目为0.1NA |
| D、1mol Na2O和Na2O2固体混合物中含有的阴、阳离子总数是3NA |
下列关于物质分类的说法正确的是( )
| A、Na2O2﹑CaO﹑K2O都是碱性氧化物 |
| B、BaSO4﹑NaCl﹑KNO3溶液都是电解质 |
| C、纯碱﹑烧碱﹑碱石灰都是碱 |
| D、稀豆浆﹑果冻﹑淀粉溶液都是胶体 |
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、四种元素的单质中,Z的熔沸点最高 |
| B、最高价氧化物对应水化物的酸性W比Z弱 |
| C、Y的气态氢化物的稳定性较Z的弱 |
| D、原子半径:W>Z>Y>X |
 某化学课外小组利用如图装置探究SO2的性质.请回答下列问题:
某化学课外小组利用如图装置探究SO2的性质.请回答下列问题: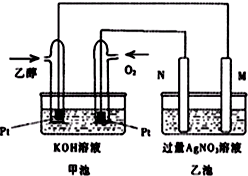 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: