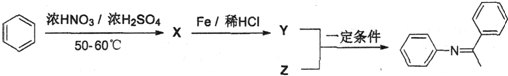
题目内容
18.下列有关说法正确的是( )| A. | 加水稀释,盐溶液中各离子的物质的量浓度均将减小 | |
| B. | 常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,则△H<0 | |
| C. | 足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少说明是强酸 | |
| D. | 葡萄糖中花青素在碱性环境下显紫色,故可用苏打粉检验假红酒 |
分析 A.加水稀释水解显酸性的盐溶液中,氢氧根离子浓度增大,水解显碱性的盐溶液中氢离子浓度增大;
B.△G=△H-T△S<0的反应能够自发进行;
C.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大;
D.苏打是碳酸钠,其溶液呈碱性,葡萄中的花青素在碱性环境下显紫色.
解答 解:A.加水稀释水解显酸性的盐溶液中,如NH4Cl溶液中NH4+水解溶液显酸性,溶液中存在离子积常数,稀释后c(H+)减小,则c(OH-)增大,水解显碱性的盐溶液中,溶液CH3COONa中,醋酸根离子水解显碱性,溶液中存在离子积常数,加水稀释,c(OH-)减小,c(H+)增大,若为NaCl溶液加水稀释,溶液中钠离子和氯离子浓度减小,c(H+)和c(OH-)不变,故A错误;
B.常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,满足△H-T△S<0,反应前后气体体积减小,则△S<0,所以只有当△H<0时,常温下△H-T△S<0,故B正确;
C.pH相等的不同一元酸,相同体积时生成氢气越多其浓度越大,足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少,所以HA的浓度小于HB,两种溶液中PH相同,氢离子浓度相等,说明HA的电离程度大,HA酸性强,但不能说明HA为强酸,故C错误;
D.苏打是碳酸钠,为强碱弱酸盐,其溶液呈碱性,葡萄中的花青素在碱性环境下显紫色,所以无法鉴别,故D错误;
故选B.
点评 本题考查有机物鉴别、酸强弱判断、焓变和熵变、盐溶液稀释等知识点,为高频考点,综合性较强,把握盐类水解、物质性质差异性、反应方向和限度判断原理是解本题关键,注意A中要根据盐特点来分析判断,为易错点.

练习册系列答案
相关题目
9.(一)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的两种工艺流程如下:
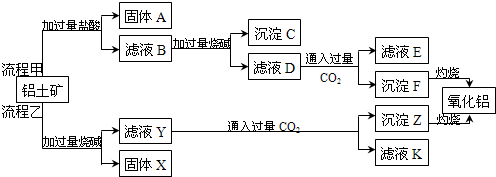
已知:
生成氢氧化物沉淀的pH
请回答下列问题
(1)固体A的主要化学成分是:SiO2(填化学式),
(2)流程乙加入烧碱后生成AlO2-的离子方程式为:Al2O3+2OH-=2AlO2-+H2O
(3)验证滤液B中含有Fe3+的实验操作为:取少量滤液B于试管中,滴加1-2滴硫氰化钾溶液,若溶液变为血红色,则说明滤液B中含有Fe3+
(4)不管是流程甲还是流程乙,都会对铝土矿进行粉碎,原因是:增大固液接触面积,加快反应速率
(5)滤液B也可以通过控制溶液的pH加入氢氧化钠直接得到沉淀F,应调节pH范围为3.2≤pH<3.4.
(二)有机化学
(6)新戊烷的系统命名法命名为:2,3-二甲基丙烷.
(7)按照官能团的分类,有机物 的类别是:酚.
的类别是:酚.
(8)乙酸的核磁共振氢谱图有2个吸收峰,面积比为:1:3或3:1.

已知:
生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(1)固体A的主要化学成分是:SiO2(填化学式),
(2)流程乙加入烧碱后生成AlO2-的离子方程式为:Al2O3+2OH-=2AlO2-+H2O
(3)验证滤液B中含有Fe3+的实验操作为:取少量滤液B于试管中,滴加1-2滴硫氰化钾溶液,若溶液变为血红色,则说明滤液B中含有Fe3+
(4)不管是流程甲还是流程乙,都会对铝土矿进行粉碎,原因是:增大固液接触面积,加快反应速率
(5)滤液B也可以通过控制溶液的pH加入氢氧化钠直接得到沉淀F,应调节pH范围为3.2≤pH<3.4.
(二)有机化学
(6)新戊烷的系统命名法命名为:2,3-二甲基丙烷.
(7)按照官能团的分类,有机物
 的类别是:酚.
的类别是:酚.(8)乙酸的核磁共振氢谱图有2个吸收峰,面积比为:1:3或3:1.
6.用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
| A. | c(H+)<c(OH-) | B. | c(HCN)<c(CN-) | ||
| C. | c(CN-)+c(OH-)=0.1mol?L-1 | D. | c(HCN)+c(CN-)=0.2mol?L-1 |
3.二氧化硫能够使高锰酸钾溶液褪色,表现了二氧化硫的( )
| A. | 酸性 | B. | 氧化性 | C. | 还原性 | D. | 漂白性 |
7.下列关于性质或用途的说法正确的是( )
| A. | 某物质灼烧时,火焰颜色为黄色,则该物质为金属钠 | |
| B. | 工业制造镁粉是将镁蒸气放在氮气中冷却 | |
| C. | 钠的化学性质很活泼,所以在自然界中只能是以游离态的形式存在 | |
| D. | 钠钾合金可以用于快中子反应堆作热交换剂 |
8.下列物质间的转化不能通过一步反应完成的是( )
| A. | CO2→C | B. | Al2O3→NaAlO2 | C. | SiO2→Si | D. | SiO2→H2SiO3 |
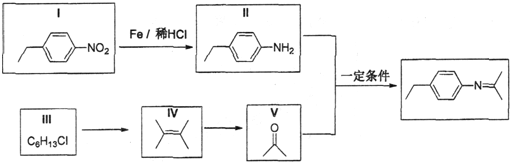

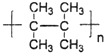
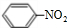 ,Z的结构简式为
,Z的结构简式为