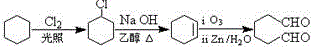
题目内容
17.T℃时在2L恒容密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示.下列说法错误的是( )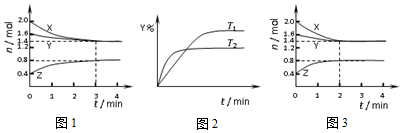
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 保持其他条件不变,升高温度,平衡向X体积分数增大的方向移动 | |
| C. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.2mol•(L•min)-1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
分析 A.根据物质的量的变化量与化学计量数成正比书写化学方程式;
B.根据图2中曲线的斜率大小判断温度的高低;
C.根据3min内X的物质的量浓度的变化量计算化学反应速率;
D.图3与图1比较,判断平衡是否发生移动,根据影响平衡移动的因素判断.
解答 解:A.根据图1分析,反应中X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,所以X、Y为反应物,Z为生成物,由于该反应反应物没有完全反应,该反应为可逆反应,根据物质的量的变化量与化学计量数成正比可知0.4mol:0.2mol:0.4mol=3:1:2,所以反应的化学方程式为3X(g)+Y(g)?2Z(g),故A正确;
B.根据图2中曲线的斜率大小判断,T2时先到达平衡状态,说明反应速率大,根据温度越高反应速率越大说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,则X的体积分数减小,故B错误;
C.反应进行的前3min内,v(X)=$\frac{\frac{0.6mol}{2L}}{3min}$=0.1mol/(L•min),故C错误;
D.图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂,故D正确;
故选BC.
点评 本题考查化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意熟练掌握化学平衡及其影响,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
14.煤、石油、天然气是人类使用的主要能源,下列说法正确的是( )
| A. | 煤、石油、天然气均为混合物,煤中含有苯等有机物 | |
| B. | 石油裂化和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化 | |
| C. | 石油的裂解主要目的是提高汽油的产量和质量 | |
| D. | 汽油燃烧产生的汽车尾气中,所含的大气污染物主要是碳氮的氧化物 |
12.在无色溶液中,下列离子能在酸性溶液中大量共存的是( )
| A. | Na+,NH4+,NO3-MnO4- | B. | Mg2+,SO42-,K+,Cl- | ||
| C. | K+,Cu2+,Cl-,Br- | D. | Ba2+,Na+,OH-,HCO3- |
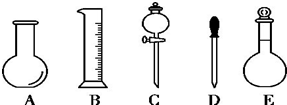
9.下列是一些装置气密性检查的方法,其中正确的是( )
| A. |  | B. |  | C. |  | D. |  |
6.为提高中和热测定的准确性,下列措施不合理的是( )
| A. | 用两只量筒分别量取所需氢氧化钠和盐酸 | |
| B. | 两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度 | |
| C. | 仪器装置保温隔热的效果要好,且操作动作要迅速 | |
| D. | 所用的氢氧化钠和盐酸溶液的浓度不宜太大,且体积和浓度均相等 |
7.下列有关说法正确的是( )
| A. | 臭氧被称为绿色氧化剂,无毒无害 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 新制备的氯水中存在3种分子、4种离子 |

 ,B的名称为苯乙烯.
,B的名称为苯乙烯.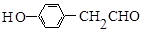 .
.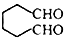 (1,6-己二醛)的合成路线.
(1,6-己二醛)的合成路线.