题目内容
2.近年来,山东省大力发展以太阳能、风能为代表的新能源.试完成下列问题.(1)现在电瓶车所用电池一般为铅蓄电池,如图1所示,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O.
则电池放电时,溶液的pH会增大(填“增大”或“减小”),写出负极反应式为Pb-2e-+SO42-=PbSO4,充电时,铅蓄电池的负极应与充电器电源的负极相连.
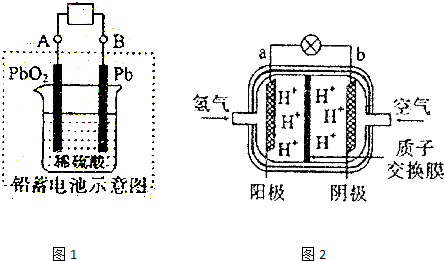
(2)为体现节能减排的理念,中国研制出了新型燃料电池汽车,该车装有“绿色心脏”一一质子交换膜燃料电池.图2是某种质子交换膜燃料电池原理示意图.该电池的正极是b(填“a”或“b”,下同)极,工作过程中,质子(H+)透过质子交换膜移动到b极.写出该电池的负极反应式为:H2-2e-=2H+.
分析 (1)放电时为原电池,根据总反应判断溶液的pH变化;负极上铅失电子发生氧化会反应;充电时,铅蓄电池的负极应与充电器电源的负极相连;
(2)燃料电池中通入氧气的一极为正极,通燃料的一极为负极;质子(H+)透过质子交换膜移动到正极;氢气在负极失电子生成氢离子.
解答 解:(1)放电时,该装置是原电池,反应过程中消耗氢离子,所以溶液的pH会增大,负极上铅失电子发生氧化会反应,电极反应式为Pb-2e-+SO42-=PbSO4,充电时,铅蓄电池的负极应与充电器电源的负极相连,
故答案为:增大;Pb-2e-+SO42-=PbSO4;负;
(2)燃料电池中通入氧气的一极为正极,通燃料的一极为负极,则该电池的正极是b极;质子(H+)透过质子交换膜移动到正极即b极;氢气在负极失电子生成氢离子,则负极的电极反应式为:H2-2e-=2H+;
故答案为:b;b;H2-2e-=2H+.
点评 本题考查了原电池和电解质的工作原理以及电极反应式的书写和离子的流向知识,明确原电池正负极的判断方法、电极反应式是解本题关键,难度中等.

练习册系列答案
相关题目
10.已知C-C可以绕键轴旋转,对结构简式如图的烃,下列说法正确的是( )


| A. | 该烃是苯的同系物 | |
| B. | 该烃分子中至少有9个碳处于同一平面上 | |
| C. | 该烃分子中的所有原子有可能处于同一平面上 | |
| D. | 该烃的一氯代物最多有四种 |
17.据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是( )
| A. | O4的摩尔质量是64g | |
| B. | O4与O3、O2互为同位素 | |
| C. | 相同质量的O4与O3所含原子个数之比为1:1 | |
| D. | 32gO4所含的电子数为32NA(NA为阿伏加德罗常数) |
7.下列离子方程式书写正确的是( )
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+CO32-+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O | |
| D. | 氢氧化钡溶液中加入硫酸:Ba2++OH-+H++SO42-═BaSO4+H2O |
14.下列物质是同学们生活中经常碰到的物质,其中属于纯净物的是( )
| A. | 水玻璃 | B. | 液氯 | C. | 漂白粉 | D. | 铝热剂 |
11.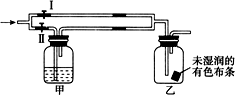 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
①浓硫酸
②饱和氯化钠溶液
③亚硫酸钠溶液
④饱和碳酸氢钠溶液.
 如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀,打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂可能是( )①浓硫酸
②饱和氯化钠溶液
③亚硫酸钠溶液
④饱和碳酸氢钠溶液.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①③④ |
12.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |