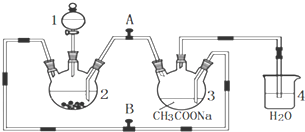
题目内容
12.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |
分析 A.由质量计算粒子数,需要知道原子的结构知识;
B.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;
C.常温常压下,Vm大于22.4L/mol;
D.NaBH4+H2O→NaBO2+H2↑,NaBH4中H为-1价,H2O的H为+1价,二者发生归中反应,水为氧化剂,NaBH4为还原剂,1molNaBH4反应转移电子数为4NA;
解答 解:A.18g甲烷(CH4)的物质的量为:18g÷18g/mol═1mol,每摩甲烷含中子数为8mol,故18g甲烷所含的中子数为8×NA,故A错误;
B.Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;7.8g Na2S和Na2O2的混合物物质的量为0.1mol,含有的阴离子数0.1NA;故B错误;
C.1mol NaHCO3与足量稀硫酸反应生成1mol二氧化碳,常温常压下,Vm大于22.4L/mol,所以生成二氧化碳体积大于22.4L,故C正确;
D.NaBH4+H2O→NaBO2+H2↑,NaBH4中H为-1价,H2O的H为+1价,二者发生归中反应,水为氧化剂,NaBH4为还原剂,1molNaBH4反应转移电子数为4NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意明确甲烷结构,NaBH4中氢元素化合价为-1价,熟练掌握公式的使用和物质的结构是解题关键,题目难度中等.

练习册系列答案
相关题目
3.已知氧化性Br2>Fe3+.FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++b Br-+c Cl2→d Fe3++e Br2+f Cl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |
20.参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )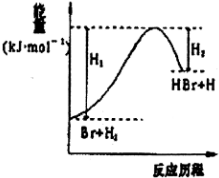

| A. | 该反应为可逆反应 | B. | 加入催化剂,可提高HBr的产率 | ||
| C. | 反应物总能量低于生成物总能量 | D. | 反应物总键能低于生成物总键能 |
7.欲检验某苯溶液中是否混有甲苯,可用下列的哪种试剂( )
| A. | NaOH溶液 | B. | 溴水 | C. | 清水 | D. | 酸性KMnO4溶液 |
17.下列装置或操作不正确的是( )
| A. | 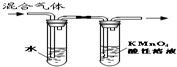 装置可用于检验溴乙烷消去反应的产物 | |
| B. |  装置可用于放出碘的四氯化碳溶液 | |
| C. | 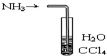 装置可用于吸收NH3防止倒吸 | |
| D. | 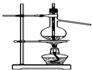 装置可用于实验室制备蒸馏水 |
1.化学与生产、生活、社会密切相关,下列说法不正确的是( )
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 | |
| B. | 工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关 | |
| C. | 以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
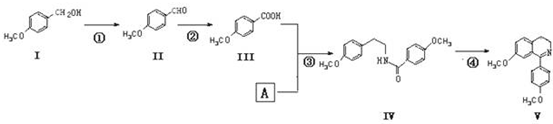
 .
.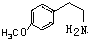 .
.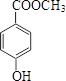 (或
(或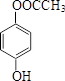 、
、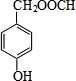 ).
).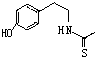 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为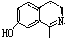 .
.