题目内容
铝镁合金0.2g完全溶于盐酸中,加入过量的氢氧化钠溶液,得到白色沉淀,将此沉淀洗净后,溶于25mL 0.2mol/L的盐酸中.再用0.05mol/L的氢氧化钠溶液中和过量的酸时,共用去18mL碱液.求合金中镁的质量分数.
考点:有关混合物反应的计算
专题:守恒法
分析:镁、铝合金加入盐酸,使之完全溶解 (酸过量),所得溶液含有氯化镁、氯化铝、剩余的盐酸,再加入过量的未知浓度的氢氧化钠,得到沉淀为Mg(OH)2,铝形成偏铝酸钠,在滤液中,向沉淀中加入0.2mol/L盐酸25mL,沉淀完全溶解,剩余盐酸用氢氧化钠中和,根据氢氧化钠的量可计算出剩余盐酸的量,进而计算出氢氧化镁的量,根据原子守恒计算出镁的量,进而计算镁和铝的质量,利用质量分数定义计算.
解答:
解:镁、铝合金加入盐酸,使之完全溶解 (酸过量),所得溶液含有氯化镁、氯化铝、剩余的盐酸,再加入过量的未知浓度的氢氧化钠,得到沉淀为Mg(OH)2.
中和过量盐酸的氢氧化钠的物质的量为:0.05mol/L×0.018L=0.0009mol,则与氢氧化镁反应的盐酸为:0.2mol/L×0.025L-0.0009mol=0.0041mol;
根据反应:Mg(OH)2+2HCl=MgCl2+H2O可知氢氧化镁的物质的量=
=0.00205mol,根据Mg元素守恒可知,m(Mg)=0.00205mol×24g/mol=0.0492g,
故混合物中Mg的质量分数为
×100%=24.6%,
答:原来混合物中镁的质量分数分别为24.6%.
中和过量盐酸的氢氧化钠的物质的量为:0.05mol/L×0.018L=0.0009mol,则与氢氧化镁反应的盐酸为:0.2mol/L×0.025L-0.0009mol=0.0041mol;
根据反应:Mg(OH)2+2HCl=MgCl2+H2O可知氢氧化镁的物质的量=
| 0.0041mol |
| 2 |
故混合物中Mg的质量分数为
| 0.0492g |
| 0.2g |
答:原来混合物中镁的质量分数分别为24.6%.
点评:考查混合物的有关计算,难度中等,清楚反应过程是解题的关键,注意守恒思想的运用,简化计算过程.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
党的十八大报告中提出,要大力推进生态文明建设,坚持节约资源和保护环境.下列做法符合报告要求的是( )
| A、采用焚烧或深埋的方法处理垃圾 |
| B、推广使用太阳能、风能等新能源 |
| C、提高煤和石油的产量以满足社会对能源的需求 |
| D、将未经处理的工业废水直接排入江河湖泊 |
将10.6g由Mg、Al、Si组成的合金投入足量的NaOH溶液中,在标准状况下产生气体11.2L;另取等质量的合金溶于过量稀H2SO4中,合金质量减少了7.8g.则合金中Mg、Al、Si的物质的量之比为( )
| A、1:2:1 |
| B、2:1:1 |
| C、1:3:2 |
| D、1:1:2 |
1998年出现的全球温度大幅度升高,产生了显著的“厄尓尼诺”现象,干旱和暴雨危害了许多地区.为了防止气候进一步变暖,联合国环境保护组织要求各国减少工业排放量的气体是( )
| A、SO2 |
| B、H2S |
| C、SO3 |
| D、CO2 |
下列物质转化在给定条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③饱和NaCl(aq)
NaHCO3
Na2CO3
④MgCl2(aq)
Mg(OH)2
MgO
⑤Cl2
FeCl3
FeCl2.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2/点燃 |
| H2O |
③饱和NaCl(aq)
| NH3CO3 |
| △ |
④MgCl2(aq)
| 石灰乳 |
| 燃烧 |
⑤Cl2
| Fe |
| Fe |
| A、①③④⑤ | B、②③④ |
| C、①②④ | D、①②③④⑤ |
 2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )
2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )| A、用“绿色化学”工艺,使原料尽可能转化为所需的物质 |
| B、回收废电池,减少对环境的污染 |
| C、为使农作物高产,大量施用化肥和农药 |
| D、推广垃圾分类存放,分类回收,分类处理 |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )
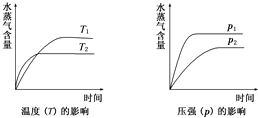

| A、2C6H5CH2CH3(g)+O2(g)?2C6H5CH=CH2(g)+2H2O(g)△H<0 |
| B、CO2(g)+H2(g)?CO(g)+H2O(g)△H>0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g)△H>0 |
| D、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0 |
已知在常温下溶液中的pH+pOH=14,又知正常人的血液的pH=7.3.则正常人血液的pOH是( )
| A、大于6.7 | B、小于6.7 |
| C、等于6.7 | D、无法判断 |