题目内容
10.下列化学反应中有电子得失的是( )| A. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | ||
| C. | Mg+Cl2$\frac{\underline{\;点燃\;}}{\;}$MgCl2 | D. | NaHCO3+HCl=NaCl+CO2↑+H2O |
分析 A.该反应中电子发生偏转,不存在电子的得失;
B.氨气为共价化合物,该反应中电子发生了偏转;
C.氯化镁为离子化合物,镁失去电子,氯气得到电子;
D.该反应为复分解反应,不存在电子得失.
解答 解:A.S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2中二氧化硫为共价化合物,反应中电子发生偏转,不存在电子的得失,故A错误;
B.N2+3H2$?_{催化剂}^{高温、高压}$2NH3中生成的氨气为共价化合物,反应中电子发生偏转,不存在电子的得失,故B错误;
C.Mg+Cl2$\frac{\underline{\;点燃\;}}{\;}$MgCl2中生成的氯化镁为离子化合物,反应中Mg失去电子,氯气得到电子,存在电子的得失,故C正确;
D.NaHCO3+HCl=NaCl+CO2↑+H2O为复分解反应,不存在电子的得失,故D错误;
故选C.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.某试剂瓶所装物质经元素分析仪确定仅含有一种元素,则该物质( )
| A. | 一定是一种单质 | B. | 一定是纯净物 | ||
| C. | 可能是混合物也可能是纯净物 | D. | 一定是同位素组成的不同单质 |
18.用于探伤的放射源Ir一192C(${\;}_{77}^{192}$Ir)丢失事件,曾引起广泛关注.下列关于的说法正确的是( )
| A. | 质子数为192 | B. | 中子数为77 | C. | 质量数为115 | D. | 电子数为77 |
5.下列表示物质结构的化学用语或模型图正确的是( )
| A. | H2O2的结构式:H-O-O-H | B. | C2H4的结构简式:CH2CH2 | ||
| C. | O2-结构示意图: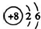 | D. | CCl4的结构式: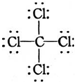 |
3.对0.10mol/L的碳酸钠溶液加热,利用传感器测定溶液的pH,结果如图所示,下列对实验结果的分析不正确的是( )
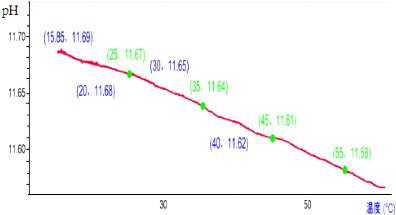

| A. | 随着温度升高溶液中c(OH-)不断减小 | |
| B. | 加热促进CO32-水解和水的电离,溶液中c(OH-)随温度升高而增大 | |
| C. | 溶液pH减小的原因是:加热促进水的电离,Kw随温度升高而增大 | |
| D. | 25℃时CO32-的水解程度约为100.67% |
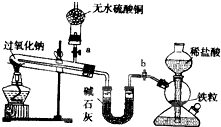 Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况下,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况下,设计了如图所示装置进行有关实验.