题目内容
11.在t℃时,将0.2mol X和0.8mol Y充入密闭容器中,当反应X(g)+Y(g)?nZ(g)+R(g)达到平衡时,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,并知c(X)c(Y)=c(Z)nc(R),则X的转化率为( )| A. | 80% | B. | 65% | C. | 45% | D. | 37% |
分析 若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,说明增大压强不影响平衡移动,则x+1=1+1,故x=1,又由于c(X)c(Y)=c(Z)c(R),则平衡常数K=1,设平衡时转化的X为amol,表示出平衡时各组分物质的量,反应前后气体的物质的量相等,利用物质的量代替浓度放入平衡常数列方程计算解答.
解答 解:在t℃时,将0.2mol X和0.8mol Y充入密闭容器中,若将反应混合气体中各物质浓度均增大一倍,X的转化率不变,说明增大压强不影响平衡移动,则x+1=1+1,故x=1,又由于c(X)c(Y)=c(Z)c(R),则平衡常数K=1,
设平衡时转化的X为amol,则:
X(g)+Y(g)?Z(g)+R(g)
起始量(mol):0.2 0.8 0 0
转化量(mol):a a a a
平衡量(mol):0.2-a 0.8-a a a
所以$\frac{a×a}{(0.2-a)×(0.8-a)}$=1,解得a=0.16
故X的转化率为$\frac{0.16mol}{0.2mol}$×100%=80%,
故选:A.
点评 本题考查化学平衡计算,关键是确定Z的化学计量数,注意平衡常数的理解及有关应用.

练习册系列答案
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
5.现有下列九种物质:
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处(每空一分):
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为1.2mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)将②加入NaOH的溶液中反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
2.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化.为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得
S2Cl2粗品.
②有关物质的部分性质如下表:
设计实验装置图如下:

(1)E中反应的化学方程式2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(2)C、D中的试剂分别是饱和食盐水、浓硫酸(填试剂名称).
(3)F的作用是导气、冷凝.
(4)如果在加热E时温度过高,对实验结果的影响是产率降低(或S2Cl2分解),在F中可能出现的现象是有黄色固体生成.
(5)S2Cl2粗品中可能混有的杂质是(填写两种)SCl2、Cl2或S,为了提高S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不要过快.
①将干燥的氯气在110℃~140℃与硫反应,即可得
S2Cl2粗品.
②有关物质的部分性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S2,300℃以上万全分解: S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2SCl2 |

(1)E中反应的化学方程式2S+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$S2Cl2.
(2)C、D中的试剂分别是饱和食盐水、浓硫酸(填试剂名称).
(3)F的作用是导气、冷凝.
(4)如果在加热E时温度过高,对实验结果的影响是产率降低(或S2Cl2分解),在F中可能出现的现象是有黄色固体生成.
(5)S2Cl2粗品中可能混有的杂质是(填写两种)SCl2、Cl2或S,为了提高S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不要过快.
19.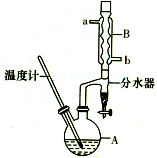 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
2CH3CH2CH2O$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如表:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70mL水的
分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,
分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加将浓H2SO4滴加到正丁醇中.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应上(填“上”或“下”)口倒出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中加热蒸馏时应收集D(填选项字母)左右的馏分.
A、100℃B、117℃C、135℃D、142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:2CH3CH2CH2O$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如表:
| 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70mL水的
分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,
分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加将浓H2SO4滴加到正丁醇中.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应上(填“上”或“下”)口倒出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中加热蒸馏时应收集D(填选项字母)左右的馏分.
A、100℃B、117℃C、135℃D、142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
6.在密闭恒容的真空容器中加入一定量纯净的氨基甲酸铵固体(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g),已知25℃时,平衡气体总浓度为2.4×10-3mol•L-1.下列说法中正确的是( )
| A. | 恒温下压缩体积,容器中气体的平均相对分子质量减少 | |
| B. | 再加入一定量氨基甲酸铵,平衡正向移动 | |
| C. | CO2的体积分数不变则该反应达到平衡状态 | |
| D. | 25℃时氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 |
16.下列说法正确的是( )
| A. | 向0.1mol•L-1氨水中加入适量NH4Cl(s),则混合液中c(NH4+)与c(NH3•H2O)之比增大 | |
| B. | 25℃时,0.1mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1mol•L-1 CH3COOH溶液中,c(CH3COO-)=c(H+) | |
| D. | 向0.1mol•L-1KNO3溶液中,滴加稀盐酸至溶液pH=5,此时混合液中c(K+)<c(NO3-) |
1.下列物质中属于电解质,且能导电的是( )
| A. | 熔融的氢氧化钾 | B. | 液态铜 | C. | 液态氯化氢 | D. | 固态氯化钾 |
 或
或 .
.