题目内容
下列离子方程式正确的是( )
| A、等物质的量浓度的FeI2溶液与溴水等体积混合2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
| B、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| C、次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D、向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
考点:离子方程式的书写
专题:
分析:A.还原性亚铁离子小于碘离子,则等物质的量反应,只有碘离子被氧化;
B.发生氧化还原反应,生成碘化亚铁、碘、水;
C.发生强酸制取弱酸的反应,生成碳酸氢钙、HClO、水;
D.恰好至中性,以2:1反应生成硫酸钡和水、硫酸钠.
B.发生氧化还原反应,生成碘化亚铁、碘、水;
C.发生强酸制取弱酸的反应,生成碳酸氢钙、HClO、水;
D.恰好至中性,以2:1反应生成硫酸钡和水、硫酸钠.
解答:
解:A.等物质的量浓度的FeI2溶液与溴水等体积混合的离子反应为2I-+Br2=I2+2Br-,故A错误;
B.氢氧化铁溶于氢碘酸中的离子反应为2Fe(OH)3+2I-+6H+═I2+2Fe2++6H2O,故B错误;
C.次氯酸钙溶液中通入过量二氧化碳的离子反应为ClO-+H2O+CO2=HCO3-+HClO,故C错误;
D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
故选D.
B.氢氧化铁溶于氢碘酸中的离子反应为2Fe(OH)3+2I-+6H+═I2+2Fe2++6H2O,故B错误;
C.次氯酸钙溶液中通入过量二氧化碳的离子反应为ClO-+H2O+CO2=HCO3-+HClO,故C错误;
D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
故选D.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及与量有关的离子反应的考查,题目难度不大.注意离子方程式历来是化学教学中的重点,也是高考较为容易考查到的知识点,离子方程式的涉及面广,尤其是和氧化还原反应或因为反应物量不同导致的多可能反应结合起来,学生显得最为困难.本题的出现旨在引起学生对于离子方程式的重视.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、在标准状况下,体积为22.4L的物质都是1mol |
| B、在非标状况下,1mol任何气体的体积不可能是22.4L |
| C、在标准状况下,1mol H2O和1mol H2的体积都为22.4L |
| D、同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同 |
下列关于胶体的叙述不正确的是( )
| A、胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9m~10-7m之间 |
| B、胶体是纯净物 |
| C、光线透过胶体时,胶体中可发生丁达尔效应 |
| D、Fe(OH)3胶体能吸附水中悬浮的固体颗粒并沉降,达到净水目的 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,18克H2O所含电子数为10 NA |
| B、将1mol FeCl3全部化成胶体,其中氢氧化铁胶粒数为NA |
| C、在常温常压下,11.2L氧气所含的原子数目为NA |
| D、标准状况下2.24L的SO3所含的原子数为0.4NA |
化学与社会、生活紧密相连.下列说法合理的是( )
| A、节日期间,在人群密集处燃放烟花爆竹 |
| B、寻找一种高效催化剂将水直接变成汽油 |
| C、炒菜时油锅中的油不慎着火,迅速盖上锅盖 |
| D、用点燃的火柴在液化气钢瓶口检验是否漏气 |
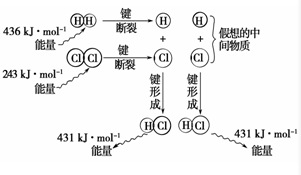 实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图: