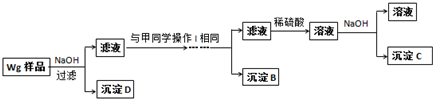
题目内容
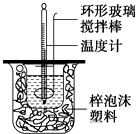 用50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
用50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题.(1)烧杯间填满碎泡沫塑料的作用是
(2)环形玻璃搅拌棒能否用环形铜质搅拌棒代替?
(3)实验时氢氧化钠溶液的浓度要用0.55mol?L-1的原因是:
实验中若改用60mL 0.5mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量
(4)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式:
考点:中和热的测定
专题:实验题
分析:(1)中和热测定实验成败的关键是保温工作;
(2)根据金属棒是热的良导体,易传热;
(3)根据氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据物质的量与热量的关系以及热化学方程式的书写方法来解答.
(2)根据金属棒是热的良导体,易传热;
(3)根据氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)根据物质的量与热量的关系以及热化学方程式的书写方法来解答.
解答:
解:(1)大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(2)铜质搅拌棒的导热性好,易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低,
故答案为:不能;铜质搅拌棒易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低;
(3)用过量的氢氧化钠保证盐酸反应完全,以盐酸的量为准进行准确计算,
反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.5mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
故答案为:要保证盐酸反应完全;不相等;相等;
(4)在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol.
故答案为:减少实验过程中的热量损失;
(2)铜质搅拌棒的导热性好,易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低,
故答案为:不能;铜质搅拌棒易传热,散发热量,会使测出的温度偏低,所得中和热的测定值比理论值偏低;
(3)用过量的氢氧化钠保证盐酸反应完全,以盐酸的量为准进行准确计算,
反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.5mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
故答案为:要保证盐酸反应完全;不相等;相等;
(4)在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol.
点评:本题考查中和热的测定,注意理解中和热的概念以及热化学方程式的书写,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
反应2SO2+O2?2SO3经过一段时间后,O2的浓度增加了0.2mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L?s),则这段时间为( )
| A、0.1 s |
| B、2.5 s |
| C、5 s |
| D、10 s |
只用一种试剂就能鉴别出NH4Cl、Na2SO4、(NH4)2SO4、三种溶液(允许加热),应选择( )
| A、BaCl2 |
| B、HCl |
| C、NaOH |
| D、Ba(OH)2 |
下列物质中,不属于合金的是( )
| A、硬铝 | B、水银 | C、黄铜 | D、钢铁 |