题目内容
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在.所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3?H2O.
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水.与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+甲同学设计的实验方案如下:

(1)方案中试剂M是 ;沉淀B是 .
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 .
(3)若金属中含铝,则沉淀 (选填沉淀编号)的质量不为零;若金属中含锌,则沉淀 (选填沉淀编号)的质量不为零.
(4)乙同学对甲同学的方案做了如下改进:
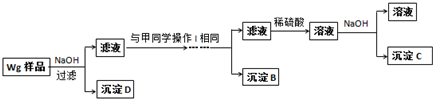
与甲同学的方案相比,此方案的优点有 .
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图象正确的是 .
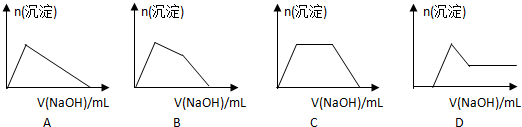
(6)上题中当沉淀质量最大时,溶液呈 (从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈 .
A.酸性 B.中性 C.碱性 D.可能酸性,也可能碱性.
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水.与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+甲同学设计的实验方案如下:

(1)方案中试剂M是
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入
(3)若金属中含铝,则沉淀
(4)乙同学对甲同学的方案做了如下改进:

与甲同学的方案相比,此方案的优点有
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图象正确的是

(6)上题中当沉淀质量最大时,溶液呈
A.酸性 B.中性 C.碱性 D.可能酸性,也可能碱性.
考点:探究物质的组成或测量物质的含量,物质分离和提纯的方法和基本操作综合应用
专题:实验探究和数据处理题
分析:根据甲同学设计实验方案,样品加入酸之后生成了镁盐、铝盐和锌盐,镁盐加过量的强碱生成了沉淀不溶解,而铝盐和锌盐加过量的强碱先生成了沉淀然后沉淀溶解;而镁盐、铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,锌盐加过量的弱碱先生成了沉淀然后沉淀溶解,由实验方案可知镁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Mg(OH)2,试剂M为过量NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀;
(1)分析可知M为过量氢氧化钠溶液,沉淀B为氢氧化铝;
(2)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;
(3)依据上述分析可知,若金属中含铝,则沉淀B不为0;若金属中含锌,则沉淀C不为0;
(4)根据对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸;
(5)根据反应的先后顺序以及量的关系来分析.
(6)依据(5)中分析沉淀质量最大是锌、铝全部沉淀,则溶液中铵根离子水解显酸性,但沉淀只有一种成分,Al(OH)3~NaOH,Zn(OH)2~2NaOH,相同物质的量的沉淀溶解消耗的NaOH不同,则为Zn(OH)2,溶液中含有偏铝酸钠,溶液呈碱性.
(1)分析可知M为过量氢氧化钠溶液,沉淀B为氢氧化铝;
(2)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;
(3)依据上述分析可知,若金属中含铝,则沉淀B不为0;若金属中含锌,则沉淀C不为0;
(4)根据对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸;
(5)根据反应的先后顺序以及量的关系来分析.
(6)依据(5)中分析沉淀质量最大是锌、铝全部沉淀,则溶液中铵根离子水解显酸性,但沉淀只有一种成分,Al(OH)3~NaOH,Zn(OH)2~2NaOH,相同物质的量的沉淀溶解消耗的NaOH不同,则为Zn(OH)2,溶液中含有偏铝酸钠,溶液呈碱性.
解答:
解:由实验方案可知镁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Mg(OH)2,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,实现了Al(OH)3沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀;
(1)上述分析可知M为过滤的氢氧化钠溶液,沉淀B为Al(OH)3沉淀,故答案为:过量NaOH溶液;Al(OH)3;
(2)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)3沉淀的分离;
故答案为:稀硫酸;稀氨水;
(3)依据上述分析可知,若金属中含铝,则沉淀B为氢氧化铝不为0;若金属中含锌,则沉淀C为氢氧化锌不为0,故答案为:B;C;
(4)对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸,故答案为:步骤简单,节约试剂;
(5)先发生的反应是Al3+和Zn2+与OH-生成沉淀,随后随着NaOH的加入,沉淀减少直至消失,此时是因为生成的沉淀都能溶解在NaOH溶液中,但Al(OH)3~NaOH,Zn(OH)2~2NaOH,所以相同物质的量的沉淀溶解消耗的NaOH不同,最后NH4+和OH-反应生成NH3?H2O,故选:B;
(6)依据(5)中分析沉淀质量最大是锌、铝全部沉淀,则溶液中铵根离子水解显酸性,但沉淀只有一种成分,Al(OH)3~NaOH,Zn(OH)2~2NaOH,相同物质的量的沉淀溶解消耗的NaOH不同,则为Zn(OH)2,溶液中含有偏铝酸钠,溶液呈碱性,
故答案为:A;C.
(1)上述分析可知M为过滤的氢氧化钠溶液,沉淀B为Al(OH)3沉淀,故答案为:过量NaOH溶液;Al(OH)3;
(2)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)3沉淀的分离;
故答案为:稀硫酸;稀氨水;
(3)依据上述分析可知,若金属中含铝,则沉淀B为氢氧化铝不为0;若金属中含锌,则沉淀C为氢氧化锌不为0,故答案为:B;C;
(4)对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸,故答案为:步骤简单,节约试剂;
(5)先发生的反应是Al3+和Zn2+与OH-生成沉淀,随后随着NaOH的加入,沉淀减少直至消失,此时是因为生成的沉淀都能溶解在NaOH溶液中,但Al(OH)3~NaOH,Zn(OH)2~2NaOH,所以相同物质的量的沉淀溶解消耗的NaOH不同,最后NH4+和OH-反应生成NH3?H2O,故选:B;
(6)依据(5)中分析沉淀质量最大是锌、铝全部沉淀,则溶液中铵根离子水解显酸性,但沉淀只有一种成分,Al(OH)3~NaOH,Zn(OH)2~2NaOH,相同物质的量的沉淀溶解消耗的NaOH不同,则为Zn(OH)2,溶液中含有偏铝酸钠,溶液呈碱性,
故答案为:A;C.
点评:本题主要考查了金属的性质以及实验方案的设计,难度较大,尤其是铝、锌及其化合物性质的运用,流程分析是关键.

练习册系列答案
相关题目
下列图示与对应的叙述相符的是( )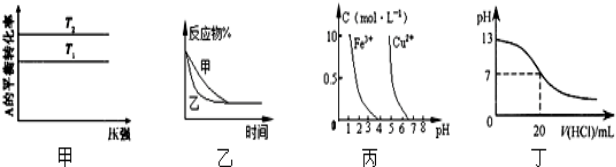

| A、图甲可以判断出反应A(g)+B(g)?2C(g)的△H<0,T2>T1 |
| B、图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量的CuO,调节pH≈4 |
| D、图丁表示25℃时,用0.1 mol/L 盐酸滴定20 ml 0.1mol/LNaOH溶液,溶液的pH随加入盐酸体积的变化 |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 | ||
B、c(OH-)=
| ||
| C、使石蕊试液呈紫色的溶液 | ||
| D、c(H+)=10-7mol/L的溶液 |
下列物质不能通过化合反应制得的是( )
| A、Fe(OH)2 |
| B、Fe(OH)3 |
| C、CaSiO3 |
| D、Fe(NO3)3 |
下列叙述正确的是( )
| A、交叉分类法和树状分类法是化学上仅有的两种分类方法 |
| B、化合物中某元素处于最高价只能被还原 |
| C、H2SO4在电流作用下在水中电离出H+和SO42- |
| D、偏二甲肼(分子式:C2H8N2)是一种有机高能燃料,它的摩尔质量为60g |
下列溶液中的c(Cl-) 与150mL、1mol/LAlCl3 溶液中的c(Cl-) 相等的是( )
| A、150 mL、1 mol/L NaCl溶液 |
| B、25 mL、3 mol/L NH4Cl 溶液 |
| C、75 mL、2 mol/L MgCl2溶液 |
| D、75 mL、2 mol/L FeCl3溶液 |


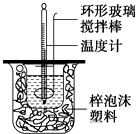 用50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题.
用50mL 0.50mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题.