题目内容
12.亚磷酸(H3PO3)是二元酸,0.1000mol/L的H3PO3溶液pH=1.6.下列判断错误的是( )| A. | HPO32-既能电离也能水解 | |
| B. | Na2HPO3溶液一定呈碱性 | |
| C. | H3PO3具有还原性 | |
| D. | H3PO3的溶液中加入过量NaOH,生成Na3PO3 |
分析 亚磷酸(H3PO3)是二元酸,0.1000mol/L的H3PO3溶液pH=1.6,说明亚磷酸是二元弱酸;
A.亚磷酸是二元弱酸,HPO32-为亚磷酸酸根离子;
B.Na2HPO3为强碱弱酸盐,亚磷酸根离子能发生水解反应;
C.亚磷酸中P元素化合价为+3价,处于中间价态;
D.Na2HPO3为亚磷酸正盐.
解答 解:亚磷酸(H3PO3)是二元酸,0.1000mol/L的H3PO3溶液pH=1.6,说明亚磷酸是二元弱酸;
A.亚磷酸是二元弱酸,HPO32-为亚磷酸酸根离子,能发生水解但不能电离,故A错误;
B.Na2HPO3为强碱弱酸盐,亚磷酸根离子能发生水解反应而使其水溶液呈碱性,故B正确;
C.亚磷酸中P元素化合价为+3价,处于中间价态,具有氧化性和还原性,故C正确;
D.亚磷酸是二元酸,则Na2HPO3为亚磷酸正盐,所以H3PO3的溶液中加入过量NaOH,生成Na2HPO3,故D错误;
故选AD.
点评 本题考查弱电解质的电离,为高频考点,侧重考查学生获取信息利用信息解答问题能力,正确理解“二元酸”概念是解本题关键,注意亚磷酸正盐中含有H元素,易错选项是D.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
2.下列说法正确的是( )
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA | |
| B. | 1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | H2S的水溶液中存在下列平衡:H2S?2H++S2- | |
| D. | 8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H<0,则该反应一定能自发进行 |
20.135℃,101.3kPa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下).若a=10时,该烃可能的分子式是( )
| A. | C4H8或C5H8 | B. | C3H8或C5H8 | C. | C4H8或C3H8 | D. | C5H8或C6H10 |
7.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 3.0g乙酸与甲酸甲酯的混合物中含有氧原子数目为0.2NA | |
| B. | 苯与液溴反应生成1mol溴苯分子,消耗0.5NA个Br2 | |
| C. | 常温常压下,等质量的N2H4和CH3OH含有相同数目的原子 | |
| D. | 6gSiO2晶体中含有0.4NA个Si-O键 |
5.目前,我国采用“接触法”制硫酸.有关接触法制硫酸的下列说法中,正确的是( )
| A. | 二氧化硫的接触氧化在合成塔中发生 | |
| B. | 吸收塔得到的硫酸浓度为98% | |
| C. | 煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% | |
| D. | 接触室中适宜条件是V2O5作催化剂、高温、常压 | |
| E. | 接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率 |
12.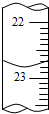 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是托盘天平和250mL容量瓶.
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②酸化KMnO4溶液的酸应为稀硫酸.(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:□MnO→+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
①a的读数如图所示,则a=22.80;
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏低的是C.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是托盘天平和250mL容量瓶.
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②酸化KMnO4溶液的酸应为稀硫酸.(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:□MnO→+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏低的是C.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
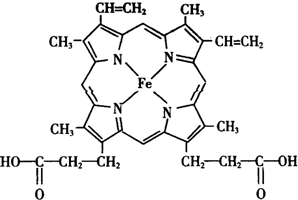 人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答:
人类很早就懂得使用铁器,如今对铁元素的研究依然热度不减.请回答: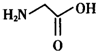 ),其分子中σ键和π键的个数比为9:1.
),其分子中σ键和π键的个数比为9:1.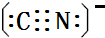 ,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
,与其配体互为等电子体的微粒有N2、CO(任写两种,填化学式).
 .
.