题目内容
Ⅰ、砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 .
(2)AsH3是无色稍有大蒜味的气体.AsH3的沸点高于PH3,其主要原因是 .
(3)Na3AsO4可作杀虫剂.AsO43-的空间构型为 ,与其互为等电子体的一种分子为 .
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示.该化合物的化学式为 ,As原子采取 杂化.
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似.GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母).
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
Ⅱ、(1)某元素第一至第四电离能数据依次是580,1800,2700,11600,则它最有可能是 区的元素,位于 族
(2)某金属元素核外电子有29种运动状态,则共有 种不同形状的原子轨道
(3)氮元素的电离能突增应出现在第 电离能
(4)已知某单质晶体的原子堆积为ABAB型,如果它的摩尔质量为M,晶胞棱长为a,晶胞高度为C,则该晶体的密度表达式为 (阿附加德罗常数用NA表示,不化简)
(1)基态砷原子的电子排布式为
(2)AsH3是无色稍有大蒜味的气体.AsH3的沸点高于PH3,其主要原因是

(3)Na3AsO4可作杀虫剂.AsO43-的空间构型为
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示.该化合物的化学式为
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似.GaAs晶体中,每个As与
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
Ⅱ、(1)某元素第一至第四电离能数据依次是580,1800,2700,11600,则它最有可能是
(2)某金属元素核外电子有29种运动状态,则共有
(3)氮元素的电离能突增应出现在第
(4)已知某单质晶体的原子堆积为ABAB型,如果它的摩尔质量为M,晶胞棱长为a,晶胞高度为C,则该晶体的密度表达式为
考点:晶胞的计算,元素周期表的结构及其应用,元素周期律的作用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:I、(1)As的原子序数为33,其最外层的p电子为半满,为稳定结构;
(2)分子晶体,相对分子质量越大,范德华力越大,熔沸点越高;
(3)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)×
=0,为sp3杂化;等电子体的原子数和价电子数相同;
(4)根据分子结构可知,分子内含有6个氧原子,4个砷原子,化学式为As4O6;As形成3个共价键;
(5)晶体结构与金刚石相似,则为原子晶体,以共价键形成空间网状结构;
Ⅱ、(1)某元素第一至第四电离能数据依次是580,1800,2700,11600,三与四电离能差别大,则最外层有3个电子;
(2)某金属元素核外电子有29种运动状态,则核外有29个电子;
(3)氮元素的最外层有5个电子,当失去第6个电子时需要的能量较大;
(4)晶体的原子堆积为ABAB型,为六方最密堆积,晶胞如图: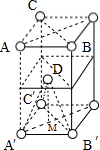 ,每个晶胞中含有两个原子,摩尔质量为M,晶胞的质量
,每个晶胞中含有两个原子,摩尔质量为M,晶胞的质量
,晶胞棱长为a,晶胞高度为C,晶胞体积为a2csin60°,结合ρ=
计算.
(2)分子晶体,相对分子质量越大,范德华力越大,熔沸点越高;
(3)AsO43-中,成键数为4,孤对电子数为(5+3-2×4)×
| 1 |
| 2 |
(4)根据分子结构可知,分子内含有6个氧原子,4个砷原子,化学式为As4O6;As形成3个共价键;
(5)晶体结构与金刚石相似,则为原子晶体,以共价键形成空间网状结构;
Ⅱ、(1)某元素第一至第四电离能数据依次是580,1800,2700,11600,三与四电离能差别大,则最外层有3个电子;
(2)某金属元素核外电子有29种运动状态,则核外有29个电子;
(3)氮元素的最外层有5个电子,当失去第6个电子时需要的能量较大;
(4)晶体的原子堆积为ABAB型,为六方最密堆积,晶胞如图:
 ,每个晶胞中含有两个原子,摩尔质量为M,晶胞的质量
,每个晶胞中含有两个原子,摩尔质量为M,晶胞的质量| 2M |
| NA |
| m |
| V |
解答:
解:(1)As的原子序数为33,由构造原理可知电子排布为[Ar]3d104s24p3,其最外层的4p电子为半满,为稳定结构,则第一电离能较大为As,
故答案为:[Ar]3d104s24p3;As;
(2)AsH3和PH3形成的晶体均是分子晶体,其沸点受分子间作用力大小的影响,对于组成和结构相似的物质分子间作用力和其相对原子质量成正比,所以AsH3的沸点高于PH3,故答案为:AsH3的相对分子质量大于PH3的相对分子质量,故AsH3分子间作用力大于PH3分子间作用力;
(3)AsO43-中含有的孤电子对数是0,中心原子有4个共价键,所以其构型是正四面体形.原子总数相同.价电子总数相同的分子称为等电子体.AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为四氯化碳,故答案为:正四面体形;CCl4;
(4)根据分子结构可知,分子内含有6个氧原子,4个砷原子,化学式为As4O6,每个As原子形成3个共价键,又因为中心原子还有1对孤对电子,所以采用的是sp3杂化,
故答案为:As4O6;sp3;
(5)金刚石形成的晶体属于原子晶体,碳原子可以形成4个碳碳单键,所以每个As应与4个Ga相连,金刚石中含有的化学键是共价键,所以该物质中含有的化学键是极性键,单键为σ键,又因为砷原子还有1对孤对电子,而镓原子有容纳孤对电子的空轨道,所以还可以构成配位键,
故答案为:4;BEG;
Ⅱ、(1)某元素第一至第四电离能数据依次是580,1800,2700,11600,三与四电离能差别大,则最外层有3个电子,最后填充p电子,为p区元素,为第ⅢA族元素,
故答案为:p;ⅢA;
(2)某金属元素核外电子有29种运动状态,则核外有29个电子,需要填充1s、2s、2p、3s、3p、3d、4s电子,共有s、p、d三种不同形状的原子轨道,
故答案为:三;
(3)氮元素的最外层有5个电子,当失去第6个电子时需要的能量较大,则电离能突增应出现在第6电离能,故答案为:6;
(4)晶体的原子堆积为ABAB型,为六方最密堆积,晶胞如图: ,每个晶胞中含有两个原子,摩尔质量为M,晶胞的质量
,每个晶胞中含有两个原子,摩尔质量为M,晶胞的质量
,晶胞棱长为a,晶胞高度为C,晶胞底面菱形的锐角为60°,晶胞体积为a2csin60°,由ρ=
可知,密度为
,故答案为:
.
故答案为:[Ar]3d104s24p3;As;
(2)AsH3和PH3形成的晶体均是分子晶体,其沸点受分子间作用力大小的影响,对于组成和结构相似的物质分子间作用力和其相对原子质量成正比,所以AsH3的沸点高于PH3,故答案为:AsH3的相对分子质量大于PH3的相对分子质量,故AsH3分子间作用力大于PH3分子间作用力;
(3)AsO43-中含有的孤电子对数是0,中心原子有4个共价键,所以其构型是正四面体形.原子总数相同.价电子总数相同的分子称为等电子体.AsO43-中含有5个原子,32个价电子,所以与其互为等电子体的一种分子为四氯化碳,故答案为:正四面体形;CCl4;
(4)根据分子结构可知,分子内含有6个氧原子,4个砷原子,化学式为As4O6,每个As原子形成3个共价键,又因为中心原子还有1对孤对电子,所以采用的是sp3杂化,
故答案为:As4O6;sp3;
(5)金刚石形成的晶体属于原子晶体,碳原子可以形成4个碳碳单键,所以每个As应与4个Ga相连,金刚石中含有的化学键是共价键,所以该物质中含有的化学键是极性键,单键为σ键,又因为砷原子还有1对孤对电子,而镓原子有容纳孤对电子的空轨道,所以还可以构成配位键,
故答案为:4;BEG;
Ⅱ、(1)某元素第一至第四电离能数据依次是580,1800,2700,11600,三与四电离能差别大,则最外层有3个电子,最后填充p电子,为p区元素,为第ⅢA族元素,
故答案为:p;ⅢA;
(2)某金属元素核外电子有29种运动状态,则核外有29个电子,需要填充1s、2s、2p、3s、3p、3d、4s电子,共有s、p、d三种不同形状的原子轨道,
故答案为:三;
(3)氮元素的最外层有5个电子,当失去第6个电子时需要的能量较大,则电离能突增应出现在第6电离能,故答案为:6;
(4)晶体的原子堆积为ABAB型,为六方最密堆积,晶胞如图:
 ,每个晶胞中含有两个原子,摩尔质量为M,晶胞的质量
,每个晶胞中含有两个原子,摩尔质量为M,晶胞的质量| 2M |
| NA |
| m |
| V |
| 2M |
| a2csin60°NA |
| 2M |
| a2csin60°NA |
点评:本题考查较综合,涉及晶体类型、等电子体、晶胞计算、杂化类型及空间结构、电子排布式、第一电离能等,注重原子结构与性质的考查,题目难度中等,(1)中注意半满为稳定结构.

练习册系列答案
相关题目
已知Fe3O4可表示成(FeO?Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法不正确的是( )
| A、O2是氧化剂,S2O32-和Fe2+是还原剂 |
| B、每生成1molFe3O4,则转移电子数为4mol |
| C、若有2molFe2+被氧化,则被Fe2+还原的O2为0.5mol |
| D、参加反应的氧化剂与还原剂的物质的最之比为1:5 |
如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )


| A、甲池中负极反应为:N2H4-4e-═N2+4H+ |
| B、甲池溶液pH不变,乙池溶液pH减小 |
| C、甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体 |
| D、反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 |
可以用分液漏斗分离的一组混合物是( )
| A、酒精和碘 | B、溴和四氯化碳 |
| C、乙酸和水 | D、苯和水 |
化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A、从海水提取物质都必须通过化学反应才能实现 |
| B、合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
| C、光化学烟雾不会引起呼吸道疾病 |
| D、维生素C具有还原性,在人体内起抗氧化作用 |