题目内容
13.用质量均为100g的铜棒作电极,电解硝酸银溶液,电解一段时间后,两个电极的质量差为28g,则阴极的质量为( )| A. | 128 g | B. | 114 g | C. | 119 g | D. | 121.6 g |
分析 用铜作电极电解硝酸银溶液时,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu 2+,阴极上银离子得电子生成银,电极反应式为Ag++e-=Ag,电池反应式为Cu+2Ag+=2Ag+Cu 2+,两个电极质量差为溶解铜的质量和析出银的质量之和,根据转移电子相等计算阴极的质量.
解答 解:用铜作电极电解硝酸银溶液时,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu 2+,阴极上银离子得电子生成银,电极反应式为Ag++e-=Ag,电池反应式为Cu+2Ag+=2Ag+Cu 2+,设阴极析出银的质量为x,根据转移电子相等得阳极溶解铜的质量=$\frac{xg}{\frac{108g/mol}{2}}$×64=$\frac{8x}{27}$,两个电极质量差为溶解铜的质量和析出银的质量之和,所以x+$\frac{8x}{27}$=28,x=21.6,即析出银的质量为21.6g,阴极上金属质量=100g+21.6g=121.6g,
故选D.
点评 本题以电解原理为载体考查物质的量的计算,正确理解“电解一段时间后两个电极质量差为溶解铜的质量和析出银的质量之和”为解答本题关键,再结合转移电子守恒解答即可,本题还可以采用排除法解答.

练习册系列答案
相关题目
3.设NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| B. | 28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| C. | 0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA | |
| D. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
18.图是元素周期表的一部分,表中的①~⑩中元素,用元素符号填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 .
.
(2)属于金属元素的有Na,Mg,Al,K(写两个以上,用元素符号表示,下同).
(3)主族序数与周期数之差为4的元素是O、Cl.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)属于金属元素的有Na,Mg,Al,K(写两个以上,用元素符号表示,下同).
(3)主族序数与周期数之差为4的元素是O、Cl.
2.常温常压下,amL三种气态烃以任意比混合后,和足量O2混合点燃,恢复到原状态后,测得气体体积共缩小 2amL( 不考虑CO2的溶解).则三种烃可能的组合( )
| A. | C3H8、C4H4、C4H6 | B. | CH4、C3H6、C2H2 | C. | C2H6、C3H4、C4H6 | D. | C2H4、CH4、C3H4 |

 .
.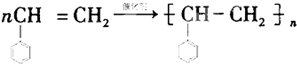 .
. 已知铜元素能形成多种化合物.
已知铜元素能形成多种化合物.