题目内容
18.茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知CaC2O4为白色沉淀物质).首先取200g茶叶样品焙烧得灰粉后进行如下操作: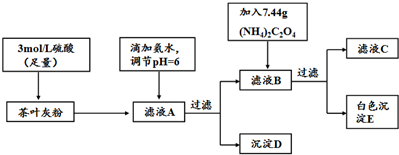
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |
①酒精灯 ②蒸发皿 ③坩埚 ④铁架台 ⑤三脚架 ⑥泥三角
(2)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.
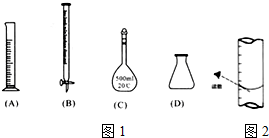
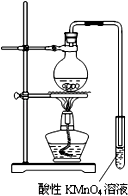
此步操作过程中一定需要用到图1中哪些仪器(填写序号)BCD;
②达到滴定终点时,溶液的颜色变化是无色变为紫色或高锰酸钾溶液不褪色;
③滴定到终点,静置后,如图2读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高 (填“偏高”、“偏低”、“无影响”).
(3)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是KSCN溶液,溶液呈红色.
分析 (1)高温灼烧物质通常在坩埚内进行,据此选择;
(2)①根据配制一定物质的量浓度的溶液方法及滴定操作方法选择使用的仪器;
②根据滴定结束前溶液为为无色,滴定结束时高锰酸钾溶液溶液过量进行解答;
③俯视液面导致滴定管中读数偏小,读出的高锰酸钾溶液体积偏小,计算出的钙离子消耗的草酸根离子物质的量偏大,测定结果偏高;
(3)根据检验铁离子遇到硫氰根离子溶液显示红色进行解答.
解答 解:(1)高温灼烧物质通常在坩埚内进行,要用到酒精灯、坩埚、泥三角、三脚架、泥三角等,不需要的仪器蒸发皿、铁架台,
故答案为:②④;
(2)①将滤液C稀释至500mL时需要使用到容量瓶,滴定操作中需要使用滴定管和锥形瓶,即B、C、D正确,
故答案为:B、C、D;
②滴定结束之前溶液为无色,滴定结束时高锰酸钾溶液过量,溶液变为紫色,所以滴定终点颜色变化为:无色变为紫色或高锰酸钾溶液不褪色,
故答案为:无色变为紫色或高锰酸钾溶液不褪色;
③滴定到终点,静置后,如图3读取KMnO4标准溶液的刻度数据,导致读数偏小,计算出的消耗的高锰酸钾溶液体积偏高,计算出的钙离子消耗的草酸根离子物质的量偏高,则测定的钙元素含量将偏高,
故答案为:偏高;
(3)滤液A中含有铁离子,可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,方法为:取少量的滤液A,滴入硫氰化钾溶液,溶液变成红色,证明溶液中存在铁离子,也证明离子茶叶中含有铁元素,
故答案为:KSCN溶液,溶液呈红色.
点评 本题考查了测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在量的方法及性质实验方案的设计,题目难度中等,注意掌握性质实验方案的设计方法,明确探究物质组成及含量的方法,试题培养了学生灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
8.下列反应中,符合能量变化如图所示的反应是( )


| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | NaOH与HCl的反应 | D. | 甲烷与O2的燃烧反应 |
9.下列有关说法不正确的是( )
| A. | 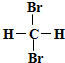 和 和 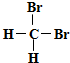 是同一物质 是同一物质 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种. | |
| C. | 某有机物化学式为C3H6O2,其核磁共振氢谱有三个峰,其强度比为3:2:1,则该有机物的结构简式一定是CH3CH2COOH | |
| D. | 在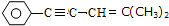 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 |
13.下列事实与其对应的方程式解释均正确的是( )
| A. | 用惰性电极电解MgCl2 溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-73kJ/mol | |
| C. | 将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-═Al2S3↓ | |
| D. | 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 |
3.下列离子方程式正确的是( )
| A. | NaHCO3溶液中加足量Ba(OH)2 溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| B. | 酸性溶液中KIO3与 KI反应生成 I2:IO3-+I-+6H+=I2+3H2O | |
| C. | NaHCO3 溶液与稀硫酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ |
8.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为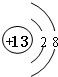 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.
(2)J和氢组成的化合物分子有4个原子,其结构式为H-C≡C-H.
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2+8H2O.
②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质.则其负极反应式为2NH3-6e-+6OH-═N2+6H2O.
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
| J | ||||
| R |
 ;元素T周期表中位于第ⅦA族.
;元素T周期表中位于第ⅦA族.(2)J和氢组成的化合物分子有4个原子,其结构式为H-C≡C-H.
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑.
(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2=N2+8H2O.
②由甲与氧气、KOH 溶液构成原电池,负极会产生L的单质.则其负极反应式为2NH3-6e-+6OH-═N2+6H2O.
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ. 该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物. .
. ;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为:
;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为: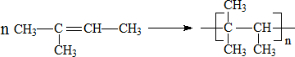 .
.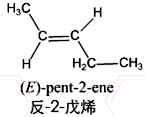 .
.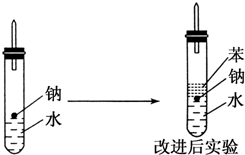 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.