题目内容
4.表为元素周期表的一部分,参照元素①-⑧在表中的位置回答下列问题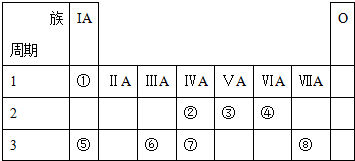
(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O.(用元素符号表示)
(2)②、③、⑧的最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>HNO3>H2CO3.(用化学式表示)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:NaOH.
(4)可以说明⑤、⑥元素原子失去电子能力相对强弱的一个事实是碱性:NaOH>Al(OH)3 等.
(5)⑥和⑧的最高价氧化物对应水化物反应的离子方程式为A1(OH)3+3H+=A13++3H2O.
(6)②和①能形成一种6原子、16电子的分子,该分子的结构简式为CH2=CH2.
(7)②和①能形成一种相对分子质量为58的分子,该分子各种同分异构体的结构简式为CH3CH2CH2CH3、
CH3CH(CH3)2.(可补充)
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(2)非金属性越强,最高价含氧酸的酸性越强;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等;
(4)金属性越强,最高价氧化物对应水化物的碱性越强;
(5)⑥和⑧的最高价氧化物对应水化物分别为A1(OH)3、HClO4,二者发生中和反应生成盐与水;
(6)②和①能形成一种6原子、16电子的分子为C2H4;
(7)②和①能形成一种相对分子质量为58的分子,则$\frac{58}{14}$=4…2,故分子为C4H10.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O,
故答案为:Na>Al>O;
(2)高氯酸的酸性最强,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>HNO3>H2CO3,
故答案为:HClO4>HNO3>H2CO3;
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等,
故答案为:NaOH等;
(4)碱性:NaOH>Al(OH)3 等,可以说明Na的金属性比Al的强,
故答案为:碱性:NaOH>Al(OH)3 等;
(5)⑥和⑧的最高价氧化物对应水化物分别为A1(OH)3、HClO4,二者发生中和反应生成盐与水,反应离子方程式为:A1(OH)3+3H+=A13++3H2O,
故答案为:A1(OH)3+3H+=A13++3H2O;
(6)②和①能形成一种6原子、16电子的分子为C2H4,该分子的结构简式为CH2=CH2,
故答案为:CH2=CH2;
(7)②和①能形成一种相对分子质量为58的分子,则$\frac{58}{14}$=4…2,故分子为C4H10,可能的结构简式为:CH3CH2CH2CH3、CH3CH(CH3)2,
故答案为:CH3CH2CH2CH3、CH3CH(CH3)2.
点评 本题考查元素周期表与元素周期律的应用,侧重于元素周期表和周期律的考查,学习中注意把握元素周期表的组成,把握元素周期律的递变规律.

已知:N-N键能193kJ•mol-1,N≡N键能946kJ•mol-1
(1)按照轨道重叠方式可知,N2分子中共价键类型为σ键、π键,其中较稳定的是π键.
(2)合成氨常用铁系催化剂,写出基态铁原子价电子排布图
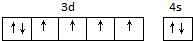 .
.(3)在较高温度下,铁对氮气的强化学吸附是合成氨速率的决定步骤.其中一种吸附方式为:
 ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.(4)氨分子空间构型是三角锥,其氮原子采用的轨道杂化方式为sp3,氨是极性(填“极性”、“非极性”)分子,能与水分子形成氢键,易溶于水.固态氨是面心立方晶胞,有关数据如下表:
| X射线衍射 | N-H键长 | N-N距离 | H-N-H键角 |
| 数据 | 101.9pm | 339.0pm | 107° |
(6)列式计算固体氨的密度.
| A. | 60s内以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的正反应为吸热反应 |
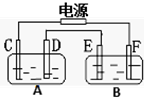
| A. | A池为电解池,B池为原电池 | B. | D、E两极都发生氧化反应 | ||
| C. | F极应为纯铜板材料 | D. | B池中E极质量增加12.8g |
| A. | NaOH | B. | Ca(OH)2 | C. | Mg(OH)2 | D. | Al(OH)3 |

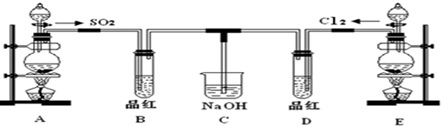
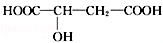 .请回答:
.请回答: