题目内容
15.Li-SOCl2电池是一种优质高效的电池,常放在心脏起搏器中,电池的总反应可表示为4Li+2SOCl2═4LiCl+S+SO2,回答下列问题:(1)电池正极发生的电极反应为2SOCl2+4Li++4e-=4LiCl+S+SO2.
(2)该电池必须在惰性环境中组装,原因是锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应.
(3)若含金属锂6.9g的电池质量为mg,平均电压为nV,则该电池的比能量为$\frac{2.68×1{0}^{4}n}{m}$W•h•kg-1(用含m、n的代数式、系数用科学记数法表示,结果保留三位有效数字;比能量=$\frac{电池输出电能}{电池质量}$,1W•h=3.6×103J,法拉第常数F=96500c•mol-1)
分析 (1)Li失电子为负极,SOCl2为正极;
(2)根据锂的活泼性以及SOCl2的性质分析;
(3)6.9g金属锂为1mol,完全反应转移电子为1mol,根据W=UIt=UQ=nQ,Q=F×转移电子数,比能量=$\frac{电池输出电能}{电池质量}$计算.
解答 解:(1)Li失电子为负极,SOCl2为正极,正极上SOCl2得电子发生还原反应,根据反应方程式知,SOCl2得电子生成LiCl、S、SO2,其正极的电极方程式为:2SOCl2+4Li++4e-=4LiCl+S+SO2;
故答案为:2SOCl2+4Li++4e-=4LiCl+S+SO2;
(2)锂和钠是同一主族的元素,性质具有相似性,钠和空气中的氧气、水蒸气反应,所以锂和空气中的氧气、水蒸气也能反应;SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行.
故答案为:锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应;
(3)6.9g金属锂为1mol,完全反应转移电子为1mol,W=UIt=UQ=nQ,Q=F×转移电子数,比能量=$\frac{电池输出电能}{电池质量}$=$\frac{F×n}{m×1{0}^{-3}×3.6×1{0}^{3}}$=$\frac{2.68×1{0}^{4}n}{m}$W•h•kg-1;
故答案为:$\frac{2.68×1{0}^{4}n}{m}$.
点评 本题考查了新型化学电源,题目难度中等,注意把握题干中的信息以及原电池的正负判断极和电极方程式的书写方法,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
5.(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+)(填“>”、“<”、或“=”).
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH>7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
①待测NaOH溶液的物质的量浓度为0.1149mol/L.(保留四位有效数字)
②下列情况可能引起测定结果偏高的是AB.
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
滴定时,你认为该滴定适宜选用的指示剂是下列中的D.
A.KBr B.KI C.K2S D.K2CrO4.
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度<MCl的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将0.1mol/L的HR溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH>7.(填“>7”、“<7”、或“无法确定”)
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
②下列情况可能引起测定结果偏高的是AB.
A.酸式滴定管未用标准盐酸溶液润洗 B.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
C.锥形瓶未用待测液润洗 D.酸式滴定管滴定前平视读数,滴定后俯视读数
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
A.KBr B.KI C.K2S D.K2CrO4.
3.配制浓度为2mol•L-1的NaOH100mL,用托盘天平称取NaOH固体时,天平读数将( )
| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
10.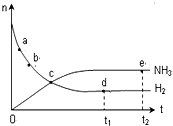 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是( )
 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d (t1时刻)和点e (t2时刻)处n(N2)不一样 | |
| D. | 若开始充入1mol N2及足量H2,提供适当条件,可得2mol NH3 |
20.25℃时,浓度均为1mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液 中c(X-)=1mol/L,BX溶液的pH=4,BY溶液的pH=6,下列说法正确的是( )
| A. | AY溶液的pH小于7 | |
| B. | AY溶液的pH小于BY溶液的pH | |
| C. | 稀释相同倍数,BX溶液的pH变化小于BY溶液 | |
| D. | 电离平衡常数K(BOH)小于K(HY) |
5.有下列物质:(1)乙醇 (2)苯酚 (3)乙醛 (4)丙烯酸 (5)乙酸乙酯.其中与溴水、KMnO4酸性溶液、Na2CO3溶液都能反应的是( )
| A. | (1)(4) | B. | (2)(4) | C. | (4) | D. | (3)(4)(5) |
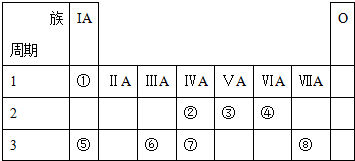
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.