题目内容
3.2molSO3和3molSO2其分子数之比为2:3;相同状况下(均为气体)体积之比为2:3;氧原子数之比为1:1.0.2 mol Al2(SO4)3中含有Al3+0.4 mol、SO42-0.6 mol.分析 由N=nNA可知,分子数目之比等于其物质的量之比,由V=nVm可知,相同条件下,气体体积之比等于其物质的量之比,结合分子式计算含有氧原子数目之比;铝离子物质的量为硫酸铝的2倍,硫酸根物质的量为硫酸铝的3倍,由此分析求解.
解答 解:由N=nNA可知,2molSO3和3molSO2其分子数之比为2mol:3mol=2:3,由V=nVm可知,相同条件下,2molSO3和3molSO2的体积之比为2mol:3mol=2:3,二者含有氧原子数目之比为2mol×3:3mol×2=1:1,铝离子物质的量为硫酸铝的2倍,硫酸根物质的量为硫酸铝的3倍,所以0.2 mol Al2(SO4)3中含有Al3+ 为 0.4mol、SO42- 为 0.6mol.故答案为:2:3;2:3;1:1; 0.4; 0.6.
点评 本题考查物质的量有关计算,侧重微粒数目计算,注意对公式的理解与灵活应用,比较基础.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
15.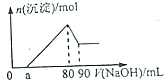 Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
 Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )
Fe2O3和Al2O3的混合物完全溶解于160mL2mol/LHCl溶液中,在所得溶液中滴加NaOH溶液得到如图,下列说法不正确的是( )| A. | 若a=20mL时,则混合物中Fe2O3占0.02mol | |
| B. | 所滴加的Na0H溶液的浓度为4mol/L | |
| C. | a点处,Na0H溶液的体积为a<50mL | |
| D. | 若a=20mL,则剩余盐酸的体积为20mL |
11.只用一种试剂就能将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是( )
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | Ba(OH)2溶液 | D. | BaCl2溶液 |
18.分子式为 C5H12O 的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)( )
| A. | 15 种 | B. | 16 种 | C. | 17 种 | D. | 18 种 |

 如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.
如图表示A--E 五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物.