题目内容
12.黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16O2若CuFeS2中Fe的化合价为+2,反应中被还原的元素是Cu、O(填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是bc(填代号).
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性可将I-氧化为I2:S2O82-+2I-=2SO42-+I2通过改变反应途径,Fe3+.Fe2+ 均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.2Fe3++2I-=2Fe2++I2.S2O82-+2Fe2+=SO42-+2Fe3+.(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3.FeO.SiO2.Al2O3)可制备Fe2O3.
方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加人过量NaOH 溶液过滤,将沉淀洗涤.干燥.煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是Al3++4OH-=AlO2-+2H2O.
b.选用提供的试剂设计实验验证炉渣中含有Fe2O3.
提供的试剂:稀盐酸.稀硫酸.KSCN溶液.KMnO4溶液.NaOH溶液.碘水
所选试剂为稀硫酸、KSCN溶液、KMnO4溶液.
证明炉渣中含有FeO 的实验现象为稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.
分析 (1)反应中化合价降低的元素被还原;
(2)冶炼过程产生大量SO2,处理方案中合理的分析是二氧化硫是污染性气体,不能排放到空气中,可以吸收利用;
(3)过二硫酸钾(K2S2O8)、三价铁离子均具有强氧化性,碘离子具有还原性,根据氧化剂和还原剂的性质以及题意信息来回答;
(4)a、氧化铝是两性氧化物,能和强酸以及强碱反应,利用氢氧化钠使其变为偏铝酸根即可;
b、证明含有Fe2O3,需要加酸溶解,然后检验铁离子;亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.
解答 解:(1)化合价降低的元素Cu、O,在反应中被还原,故答案为:Cu、O;
(2)a.二氧化硫是污染性气体,高空排放会污染空气,处理不合理,故a错误;
b.可以利用吸收二氧化硫生成硫酸,用于制备硫酸,故b合理;
c.用纯碱溶液吸收二氧化硫可以制Na2SO4,故c合理;
d.用浓硫酸不能吸收二氧化硫,故d不合理;
故答案为:b、c;
(3)根据题意过二硫酸钾(K2S2O8)、三价铁离子均具有强氧化性,碘离子具有还原性,通过改变反应途径,Fe2+均可催化反应S2O82-+2I-=2SO42-+I2;实质是:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+,
故答案为:2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;
(4)a.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++Al2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成偏铝酸根,
故答案为:Al3++4OH-=2H2O+AlO2-;
b.证明含有Fe2O3,需要加酸溶解,然后检验铁离子,所以需要稀硫酸和KSCN溶液,检验亚铁离子要利用亚铁离子的还原性,高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,
故答案为:稀硫酸、KSCN溶液、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.
点评 本题考查了硫元素及其化合物的性质,题目难度中等,题目涉及元素化合物的性质、氧化还原反应、离子方程式的书写、物质的检验等,侧重于考查学生对基础知识的综合应用能力.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| 弱酸 | 电离常数 |
| CH3COOH | K=1.75×10-5 |
| H2CO3 | K1=4.4×10-7 k2=4.7×10-11 |
| HClO | K=3.2×10-8 |
| A. | ②>④>③>① | B. | ①>③>④>② | C. | ③>②>④>① | D. | ③>④>②>① |
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |

| A. | 反应过程中的氧化产物均为SO3 | |
| B. | a点时消耗NaHSO3的物质的量为1.0 mol | |
| C. | 0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| D. | 当溶液中I?与I2的物质的量之比为1:1时,加入的NaIO3为1.2 mol |
| A. | 氧化性 | B. | 还原性 | ||
| C. | 既无氧化性又无还原性 | D. | 既有氧化性又有还原性 |
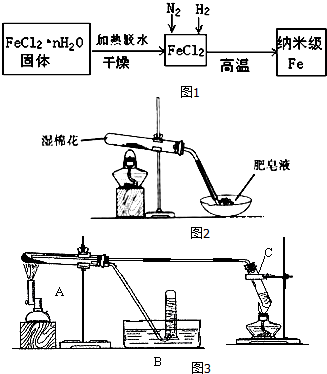
(1)生成纳米级Fe的化学方程式为FeCl2+H2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.
(2)纳米级Fe粉在空气中易自燃成黑色固体,但是生活中的铁丝或铁粉在空气中加热也不能燃烧,其原因是纳米级Fe粉与气体接触面大,反应速率快.
(3)FeCl2•nH2O固体加热脱水通常要通入干燥的HCl气流,理由是HCl抑制FeCl2水解,且通入的HCl气体可带走水蒸气.
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成Fe3O4.
甲同学用如图2所示装置进行纳米级Fe粉与水蒸气的实验:
(4)该装置中纳米级Fe粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeO+H2;
乙同学用如图3所示装置进行纳米级Fe粉与水蒸气的反应并验证产物:
(5)装置C的作用是制取水蒸气.
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了如表实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
(7)丁同学称取5.60gFe粉,用乙的装置反应一段时候后,停止加热.将试管内的固体物质在干燥
器中冷却后,称得质量为6.88g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3
的0.08mol.丁同学实验的固体产物为Fe3O4.
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与硫酸氢钠溶液混合:HCO3-+H+═H2O+CO2↑ | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | Ca(OH)2溶液中通入过量CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |