题目内容
8.在CO2的水溶液中,H2CO3达到电离平衡的标志是( )| A. | c(HCO3-)=c(CO32-) | B. | 溶液中无H2CO3 | ||
| C. | c(HCO3-)恒定不变 | D. | 溶液中H2CO3、HCO3-、CO32-共存 |
分析 在CO2的水溶液中,H2CO3的电离达到平衡时,正逆反应速率相等,溶液中各粒子浓度不变,据此分析解答.
解答 解:A.溶液中碳酸的第一步电离程度远大于第二步电离,所以c(HCO3-)>c(CO32-),不能判断是否达到电离平衡,故A错误;
B.碳酸无论是否达到电离平衡时溶液中都有碳酸分子,故B错误;
C.c(HCO3-)恒定不变时说明正逆反应速率相等,则该反应达到平衡状态,故C正确;
D.溶液中H2CO3、HCO3-、CO32-共存时不一定达到平衡状态,只有正逆反应速率相等时才能达到平衡状态,故D错误;
故选C.
点评 本题考查弱电解质电离平衡状态的判断,以化学平衡状态判断为例采用知识迁移的方法确定醋酸电离平衡状态的判断,侧重考查学生学以致用能力,题目难度不大.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
18.化学是一门以实验为基础的科学,掌握好化学实验基本操作是做好化学实验的前提.下列实验操作正确的是( )
| A. | 制取蒸馏水时,冷却水应从冷凝管的上端进入 | |
| B. | 分液时,应把下层液体从下端放出后,再把上层液体从下端放出 | |
| C. | 过滤时,漏斗的下端应紧贴烧杯内壁 | |
| D. | 萃取时,所选的萃取剂的密度应比原溶液的密度大 |
19.同温同压下,完全燃烧5L相同物质的量的甲烷和丙烷的混合气体与完全燃烧5L相同质量的乙烯和丙烯混合气体,所生成的二氧化碳质量之比为( )
| A. | 4:5 | B. | 5:3 | C. | 5:6 | D. | 6:5 |
16.2010年12月13日成都绕城高速137辆车因雾连环追尾,造成不同程度受损.雾属于下列分散系中的( )
| A. | 乳浊液 | B. | 溶液 | C. | 胶体 | D. | 悬浊液 |
20.下列有关实验现象的描述中,正确的是( )
| A. | 向氯化亚铁溶液中加入氢氧化钠溶液,先有白出现,后白色沉淀逐渐消失 | |
| B. | 将铜片放人氯化铁溶液,钢片表面生成银白色的铁 | |
| C. | 在氯化铁溶液中滴入氢氧化钠溶液,有红褐色沉淀出现 | |
| D. | 将铜粉加人冷的浓硝酸中会发生钝化 |
6.在一密闭容器中,反应 aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,
达到新的平衡时,B的浓度是原来的40%,则下列说法正确的是( )
达到新的平衡时,B的浓度是原来的40%,则下列说法正确的是( )
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率增加了 | ||
| C. | 物质B的质量分数减少了 | D. | b>a |
7.液流电池是一种新型可充电的高性能蓄电池,其工作原理如图.两边电解液存储罐盛放的电解液分别是含有V3+、V的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环.下列说法不正确的是( )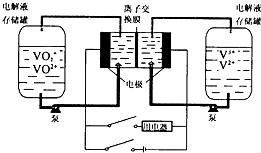

| A. | 充电时阴极的电极反应是V3++e-=V2+ | |
| B. | 放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被被氧化 | |
| C. | 若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol | |
| D. | 若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |