题目内容
3.下列依据热化学方程式得出的结论正确的是( )| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定 | |
| C. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 己知2C(s)+2O2(g)═2CO2(g);△H1 2C(s)+O2(g)═2CO(g);△H2,则△H1>△H2 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
B.物质具有的能量越低,物质越稳定;
C.在稀溶液中,强酸和强碱反应生成1mol水放出的热量为中和热,中和热的单位是kJ/mol,但热量的单位是kJ;
D.用盖斯定律得到一氧化碳燃烧生成二氧化碳,根据这个过程是放热来确定焓变的大小.
解答 解:A.选项中生成的水是气体,应该是液态水,所以不能得出氢气的燃烧热是241.8 kJ/mol,故A错误;
B.已知C(石墨,s)=C(金刚石,s)△H>0,反应是吸热反应,石墨能量低于金刚石,能量越低越稳定,所以石墨比金刚石稳定,故B正确;
C.已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20.0g NaOH物质的量为0.5mol的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,故C错误;
D.已知C(s)+O2(g)=CO2(g)△H1 ①,C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2 ②,①-②得到:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H1-△H2,一氧化碳燃烧生成二氧化碳是放热反应,焓变是负值,所以△H1<△H2,故D错误;
故选BC.
点评 本题考查热化学方程式,题目难度中等,明确热化学方程式的书写原则为解答关键,注意掌握化学反应与能力变化的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列有机物中,既能发生加成反应、酯化反应,又能发生氧化反应的是( )
①CH2OH(CHOH)4CHO
②CH3CH2CH2OH
③CH2═CH-CH2OH
④CH2═CH-COOCH3
⑤CH2═CH-COOH.
①CH2OH(CHOH)4CHO
②CH3CH2CH2OH
③CH2═CH-CH2OH
④CH2═CH-COOCH3
⑤CH2═CH-COOH.
| A. | ③⑤ | B. | ②④ | C. | ①③⑤ | D. | ①③ |
11. 的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
 的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构这三种烷烃的二氯取代产物的同分异构体数目是( )
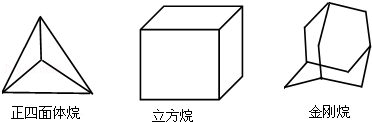

| A. | 2种 4种 8种 | B. | 2种 4种 6种 | C. | 1种 3种 6种 | D. | 1种 3种 8种 |
12.下列分子或离子中,立体构型不是平面三角形的是( )
| A. | CO32- | B. | CH4 | C. | BF3 | D. | SO3 |
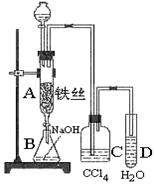 某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用图装置使苯与液溴反应.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.