题目内容
15.A~G是几种烃的分子球棍模型(如图),据此回答下列问题: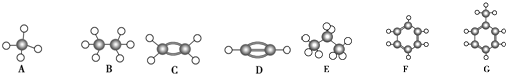
(1)常温下含碳量最高的气态烃是(填对应字母)D;
(2)能够使酸性高锰酸钾溶液褪色的烃有(填数字)3种;
(3)一卤代物种类最多的是(填名称)G;
(4)写出实验室制取的D化学方程式:CaC2+2H2O→Ca(OH)2+C2H2↑;
(5)写出F发生溴代反应的化学方程式:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
分析 有结构模型可知A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,根据物质的组成、结构和性质解答该题.
解答 解:根据球棍模型可知,A为CH4,B为CH3CH3,C为CH2=CH2,D为CH≡CH,E为CH3CH2CH3,F为苯,G为甲苯,
(1)常温下,分子中含有碳原子个数不大于4的烃为气态烃,根据其球棍模型判断,分子中含有碳氢原子个数比最大即为含碳量最高的,所以含碳量最大的是乙炔.
故答案为:D.
(2)乙烯、乙炔以及甲苯可使高锰酸钾溶液褪色,故答案为:3;
(3)一卤代物种类最多的是甲苯,共有4种,故答案为:G;
(4)实验室用碳化钙和水反应制取乙炔,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(5)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr,
故答案为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
点评 本题考查有机物的结构和性质,为高频考点,注意把握有机物的结构特点,根据结构模型判断有机物的种类为解答该题的关键,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
6.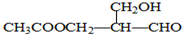 在有机物的分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
在有机物的分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
①与乙酸发生酯化反应
②与NaOH水溶液共热
③与银氨溶液作用
④在催化剂加热条件下与H2作用
⑤与CuO共热.
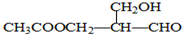 在有机物的分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )
在有机物的分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下图物质有光学活性,发生下列反应后生成的有机物仍有光学活性的是( )①与乙酸发生酯化反应
②与NaOH水溶液共热
③与银氨溶液作用
④在催化剂加热条件下与H2作用
⑤与CuO共热.
| A. | ③ | B. | ①②④⑤ | C. | ③⑤ | D. | ①②④ |
3.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ•mol-1氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0 则石墨比金刚石稳定 | |
| C. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ•mol-1则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 己知2C(s)+2O2(g)═2CO2(g);△H1 2C(s)+O2(g)═2CO(g);△H2,则△H1>△H2 |
10.实验中所测得数据中不合理的是( )
| A. | 用pH计测得某溶液的pH值为9.70 | |
| B. | 用25mL移液管移取19.50 mL的液体 | |
| C. | 用电子天平称取镀锌4.421g | |
| D. | 用25mL酸式滴定管量取16.50mLKMnO4溶液 |
20.分子式为 C5H8O2的有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)有( )
| A. | 8 种 | B. | 10 种 | C. | 11 种 | D. | 12 种 |
7.氨气遇氯气时,有白烟出现,发生的反应可能有
①2NH3+3Cl2═6HCl+N2 ②NH3+HCl═NH4Cl
下列说法正确的是( )
①2NH3+3Cl2═6HCl+N2 ②NH3+HCl═NH4Cl
下列说法正确的是( )
| A. | ①为化合反应 | B. | ②为置换反应 | C. | ①氧化还原反应 | D. | ②为复分解反应 |
5.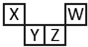 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y所形成的一种单质有毒且易自燃.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y所形成的一种单质有毒且易自燃.下列判断不正确的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y所形成的一种单质有毒且易自燃.下列判断不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y所形成的一种单质有毒且易自燃.下列判断不正确的是( )| A. | 最高正化合价:X<Y<Z<W | |
| B. | 原子半径:W<Z<Y | |
| C. | 气态氢化物的热稳定性:Y<Z<W | |
| D. | 最高价氧化物对应水化物的酸性:X<Y<Z |