题目内容
6.氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组设计下图实验装置欲制取氮化铝,应用的化学反应为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
试回答:
(1)实验中用饱和NaNO2与 NH4Cl溶液制取氮气的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O.
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是C(填写序号).
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置后的下一步操作是检查装置的气密性.
(4)有同学认为上述实验装置存在一些不足,请指出其中一个没有尾气处理装置.
(5)反应结束后,某同学用右图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气.
①广口瓶中的试剂X最好选用c(填写序号).
a.汽油 b.酒精 c.植物油 d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将不变(填“偏大”、“偏小”、“不变”).
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积3.36L(标准状况),则样品中AlN的质量分数为61.5%(保留3位有效数字).
分析 制取氮化铝:用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,装置中分液漏斗与蒸馏烧瓶之间的导管A,平衡内外压强,使NaNO2 饱和溶液容易滴下,制得的氮气排尽装置中的空气,碱石灰干燥氮气,氧化铝、碳和氮气在高温的条件下生成氮化铝和一氧化碳,方程式为:Al2O3+3C+N2$\frac{\underline{\;\;△\;\;}}{\;}$2AlN+3CO,D防止空气进入反应装置干扰实验.
(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水;
(2)根据实验的需要结合大气压强原理来回答;
(3)制备氮化铝需制备氮气,所以首先要检验装置的气密性;
(4)实验必须对有毒气体进行尾气处理,防止空气污染,CO有毒;
(5)氮化铝和氢氧化钠反应会生成氨气,氨气进入广口瓶后,如果装置密闭,广口瓶中压强会增大,那么就会有水通过广口瓶的长管进入量筒中,根据等量法可知,进入到广口瓶中水的体积就等于生成的氨气的体积.所以通过量筒中排出的水的体积就可以知道氨气的体积,然后有氨气的密度求出氨气的质量,进而根据方程式求出氮化铝的质量.
①产生的氨气极易溶于水,为防止氨气溶于水需要把气体与水隔离,因此应选择不能与氨气产生作用的液体作为隔离液;选用的试剂应是和水不互溶,且密度大于水的;
②反应前广口瓶的上方留有的少量空间填充的是空气,反应后广口瓶的上方留有的少量空间填充的是氨气,氨气代替了开始的空气,把最后空间中充入的氨气当成开始时的空气即可;
③根据氨气的体积计算出物质的量,得出其中氮原子的物质的量,根据氮原子守恒,来计算氮化铝的百分含量.
解答 解:(1)饱和NaNO2与 NH4Cl溶液反应生成氯化钠、氮气和水,反应为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,
故答案为:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O;
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A具有平衡气压的作用,这样可以保证NaNO2饱和溶液容易滴下,
故选c;
(3)制备氮化铝通过Al2O3+3C+N2$\frac{\underline{\;\;△\;\;}}{\;}$2AlN+3CO实现,先需用饱和NaNO2与NH4Cl溶液制取氮气NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,制备装置不能漏气,所以按图连接好实验装置后的下一步操作是检查装置的气密性,方法为:关闭分液漏斗开关,使装置处于密闭体系,将导管一端浸入水中,用手紧握锥形瓶外壁,由于热胀冷缩,锥形瓶内气体受热膨胀,如果导管口有气泡冒出,说明气密性良好,否则装置漏气,
故答案为:检查装置的气密性;
(4)CO有毒,实验必须对有毒气体进行尾气处理,应在干燥管D末端连接一个尾气处理装置,防止空气污染,所以实验装置存在不足为没有尾气处理装置,
故答案为:没有尾气处理装置;
(5)①酒精、汽油虽然都不能与氨气发生反应,但它们却都极易挥发,挥发出来的气体对实验有影响而且挥发完后不能再起到隔离氨气与水接触的作用;同时由于酒精易溶于水,也不能达到隔离的目的;CCl4密度大于水,不能起到隔离作用,而植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离,
故答案为:C;
②本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,因此,把最后空间中充入的氨气当成开始时的空气即可,不会对测量结果产生影响,
故答案为:不变;
③氨气的体积为3.36L(标准状况),物质的量是0.15mol,所以氮化铝的物质的量是0.15mol,质量是0.15mol×41g/mol=6.15g,所以氮化铝的质量分数为
$\frac{6.15}{10}$×100%=61.5%,
故答案为:61.5%.
点评 本题考查对实验原理的理解与实验操作评价、物质含量测定、化学计算等,题目难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.

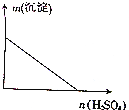 向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )
向某分散系中逐滴加入硫酸,测得溶液中沉淀的质量与加入硫酸的物质的量的关系如图所示,则该分散系可能是( )| A. | 硝酸钙与硫酸钾的混合液 | B. | 氯化钡与碳酸钠的混合液 | ||
| C. | 硫酸镁与氢氧化钾的混合液 | D. | 氯化铝与硝酸钠的混合液 |
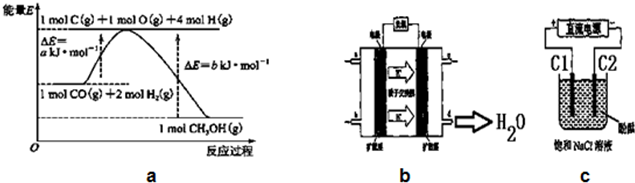
(1)写出合成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol.
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)在500℃达到平衡时,平衡常数K=25.
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为80%.
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响,无影响.(填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式O2+4e-+4H+=2H2O.
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).
①该反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
②电解开始后在电极C2的周围(填“C1”或“C2”)先出现红色.
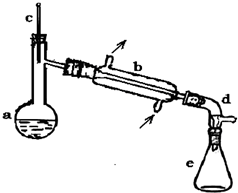 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应 和实验装置如图:
和实验装置如图:可能用到的有关数据如下:
| 相对分子质量 | 密度/(g?cm-3 ) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯11.48g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).A.立即补加B.冷却后补加C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前检漏并须清洗干净;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有ACD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是70%.

实验药品:铜,铁,镁,0.5mol/L H2SO4,2mol/L H2SO4,18.4mol/L H2SO4
Ⅰ.甲同学研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg.
(2)甲同学的实验目的是探究反应物本身的性质对反应速率的影响;要得出正确的实验结论,还需控制的实验条件是温度相同.
Ⅱ.乙同学为了更精确的研究浓度对反应速率的影响,利用右图所示装置进行实验,
(3)乙同学在实验中应该测定的数据是一定时间内产生气体的体积(或产生一定体积的气体所需的时间).
(4)乙同学完成该实验应选用的实验药品镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4.
(5)图中仪器A的名称是分液漏斗,检验该装置气密性的方法是按住注射器活塞不动,向分液漏斗中倒水,液面高度不变,说明装置气密性良好.
 (1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
(1)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应: