题目内容
14.甲醇合成反应及其能量变化如图a所示: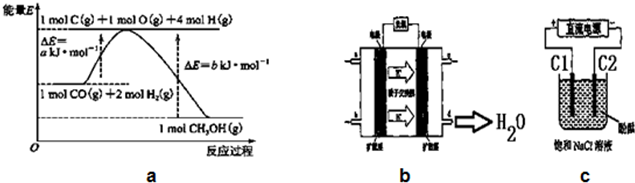
(1)写出合成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol.
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)在500℃达到平衡时,平衡常数K=25.
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为80%.
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响,无影响.(填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式O2+4e-+4H+=2H2O.
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).
①该反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
②电解开始后在电极C2的周围(填“C1”或“C2”)先出现红色.
分析 (1)由图可知,1molC(s)与2molH2(g)反应生成1molCH3OH(g)放出热量为(b-a)kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)根据v=$\frac{△c}{△t}$计算v(CH3OH),再根据速率之比等于化学计量数之比计算v(H2);
(3)500℃达到平衡时,40min处于平衡状态,计算平衡时各组分物质的量浓度,再根据平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;
(4)恒温恒容条件下,压强之比等于物质的量之比,据此计算平衡时混合气体总物质的量,利用差量法计算参加反应氢气物质的量,进而计算氢气的转化率;
(5)反应热只与始态与终态有关,与反应过程无关;
(6)氧气发生还原反应,与通过质子交换膜的氢离子结合生成水;
(7)①电解饱和食盐水生成氢氧化钠、氢气和氯气;
②C1连接电源正极,为阳极,C2连接电源负极,为阴极,电解过程中,阳极氯离子失去生成氯气,阴极水电离的氢离子得到电子生成氢气,同时产生氢氧根离子.
解答 解:(1)由图可知,1molC(s)与2molH2(g)反应生成1molCH3OH(g)放出热量为(b-a)kJ,应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol;
故答案为:CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol;
(2)在300℃反应开始10min内,生成的甲醇为0.4mol,则v(CH3OH)=$\frac{\frac{0.4mol}{1L}}{10min}$=0.04mol/(L•min),H2的平均反应速率为v(H2)=2V(CH3OH)=0.08mol/(L•min);
故答案为:0.08mol/(L•min);
(3)500℃达到平衡时,40min处于平衡状态,平衡时甲醇的浓度为0.8mol/L,则:
CO(g)+2H2(g)=CH3OH(g)
起始量(mol/L):1 2 0
变化量(mol/L):0.8 1.6 0.8
平衡量(mol/L):0.2 0.4 0.8
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.8}{0.2×0.{4}^{2}}$=25,
故答案为:25;
(4)恒温恒容条件下,压强之比等于物质的量之比,平衡时混合气体总物质的量为(1.2mol+2.0mol)×$\frac{1}{2}$=1.6mol,即混合气体减小的物质的量为1.6mol,
CO(g)+2H2(g)=CH3OH(g)物质的量减小
2 2
1.6mol 1.6mol
故该条件下H2的转化率为=$\frac{1.6mol}{2mol}$×100%=80%;
故答案为:80%;
(5)反应中的a是反应的活化能,影响因素是催化剂,反应热只与始态与终态有关,与反应过程无关,所以对反应热的影响无关;
故答案为:无影响;
(6)氧气发生还原反应,与通过质子交换膜的氢离子结合生成水,电极反应式为:O2+4e-+4H+=2H2O,
故答案为:O2+4e-+4H+=2H2O;
(7)①电解饱和食盐水生成氢氧化钠、氢气和氯气,反应离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
②C1连接电源正极,为阳极,C2连接电源负极,为阴极,电解过程中,阳极氯离子失去生成氯气,阴极水电离的氢离子得到电子生成氢气,同时产生氢氧根离子,所以在阴极C2先变红,
故答案为:C2.
点评 本题考查化学平衡计算、热化学方程式书写、电化学等,需要学生熟练掌握基础知识并灵活应用,题目难度中等.

 如图为制取乙酸乙酯的实验装置图,请回答下列问题:
如图为制取乙酸乙酯的实验装置图,请回答下列问题:(1)实验室制取乙酸乙酯的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
(2)欲提高乙酸的转化率,可采取的措施有乙醇过量、及时分离出乙酸乙酯等.
(3)若用图所示的装置来制取少量的乙酸乙酯,产率往往偏低,其原因可能是:原料来不及反应就被蒸出,温度过高,发生了副反应,冷凝效果不好,部分产物挥发了等.
(4)实验时可观察到锥形瓶中有气泡产生,用离子方程式表示产生气泡的原因:
2CH3COOH+CO32-→2CH3COO-+CO2↑+H2O.
(5)此反应以浓硫酸作为催化剂,可能会造成产生大量酸性废液,催化剂重复使用困难等问题.现代研究表明质子酸离子液体可作此反应的催化剂,实验数据如下表所示(乙酸和乙醇以等物质的量混合):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.7 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
根据表中数据,下列C(填编号),为该反应的最佳条件.
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h.
 (苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$
(苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$ (肉桂酸)+CH3COOH(乙酸)
(肉桂酸)+CH3COOH(乙酸)主要试剂及其物理性质
| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100ml溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色结晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |
主要实验步骤和装置如下:

Ⅰ合成:按图1连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾.在140~170℃,将此混合物回流45min.
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率.同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物.回答下列问题:
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥.实验中为控制温度在140~170℃需在BD中加热(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.砂子 D.植物油(沸点230~325℃)
反应刚开始时,会有乙酸酐(有毒)挥发,所以该实验应在通风橱或通风处中进行操作.
(2)图2中水蒸气蒸馏后产品在三颈烧瓶(填仪器名称)
(3)趁热过滤的目的防止肉桂酸钠结晶而析出堵塞漏斗,方法:用热过滤漏斗或采取保温措施.
(4)加入1:1的盐酸的目的是使肉桂酸盐转化为肉桂酸,析出的肉桂酸晶体通过减压过滤与母液分离.下列说法正确的是ACD.
A.选择减压过滤是因为过滤速度快而且能得到较干燥的晶体
B.放入比布氏漏斗内径小的滤纸后,直接用倾析法转移溶液和沉淀,再迅速开大水龙头抽滤
C.洗涤产物时,先关小水龙头,用冷水缓慢淋洗
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,再关水龙头
(5)5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾充分反应得到肉桂酸实际3.1g,则产率是41.9%(保留3位有效数字).


 ;再加入无水酒精又看到的现象是
;再加入无水酒精又看到的现象是