题目内容
16.把V L含MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )| A. | $\frac{b-a}{V}$ mol•L-1 | B. | $\frac{2b-a}{V}$mol•L-1 | C. | $\frac{b-a}{V}$mol•L-1 | D. | $\frac{2(2b-a)}{V}$mol/L |
分析 混合溶液分成两等份,每份溶液浓度相同.一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒可知该份中n(SO42-)=n(BaSO4)=n(BaCl2);一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,由电荷守恒可知:n(OH-)=2n(Mg2+),再利用电荷守恒可知2n(Mg2+)+n(K+)=2n(SO42-),以此计算.
解答 解:一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则n(SO42-)=bmol;
一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,则n(Mg2+)=$\frac{1}{2}$amol,
由电荷守恒可知2n(Mg2+)+n(K+)=2n(SO42-),
则n(K+)=(2b-a)mol,
混合溶液分成两等份,
原混合溶液中钾离子的浓度为$\frac{2(2b-a)}{V}$mol/L,
故选D.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系等为解答的关键,侧重分析与计算能力的考查,注意溶液均分为两份,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 1mol 苯乙烯中含有的碳碳双键数为4NA | |
| B. | 7.8g过氧化钠晶体中含有0.1NA个O22- | |
| C. | 标准状况下,22.4LNO2中含有NA个NO2分子 | |
| D. | 1 mol•L-1NH4Cl溶液中,NH4+<0的数目小于NA |
1.把1L含乙烯和氢气的混合气体通过催化剂,使乙烯和氢气发生加成反应,完全反应后,气体体积变为yL(气体体积均在同温、同压下测定).若乙烯在1L混合气体中的体积分数为x,则x和y的关系一定不正确的是( )
| A. | y=x | B. | y=1-x | C. | y=x-0.5 | D. | y=1-x<0.5 |
6.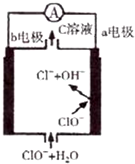 镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )
镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )
 镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )
镁一次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O═Mg(OH)2+Cl-.下列有关说法正确的是( )| A. | 电池工作时,正极a附近的pH将不断增大 | |
| B. | 电池工作时,C溶液中的溶质是MgCl2 | |
| C. | 负极反应式:ClO-+2e-+H2O=Cl-+2OH- | |
| D. | b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl- |
 和b.
和b. .请回答下列问题:
.请回答下列问题: 结构在下列哪些方面不同D(填字母代号).
结构在下列哪些方面不同D(填字母代号). 如图中A、B、C分别是三种有机物的结构模型:
如图中A、B、C分别是三种有机物的结构模型: +3H2O.
+3H2O.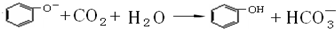 ,该反应说明苯酚具有的性质是弱酸性.
,该反应说明苯酚具有的性质是弱酸性.