题目内容
19.在0.1mol•dm-3H2S饱和溶液中,S2-(mo1•L-1)浓度为( )| A. | 0.1 | B. | 0.05 | C. | K${\;}_{a1}^{θ}$(H2S) | D. | K${\;}_{{a}_{2}}^{θ}$(H2S) |
分析 H2S饱和溶液中,H2S的电离分两步进行:H2S?H++HS-,HS-?H++S2-,且以第一步为主,即溶液中的氢离子主要来自于第一步电离,第二步电离消耗的HS-和生成的H+可以忽略不计,即可以认为溶液中的c(H+)≈c(HS-),根据H2S的第二步电离平衡常数来计算,据此分析.
解答 解:H2S饱和溶液中,H2S的电离分两步进行:H2S?H++HS-,HS-?H++S2-,且以第一步为主,即溶液中的氢离子主要来自于第一步电离,第二步电离消耗的HS-和生成的H+可以忽略不计,即可以认为溶液中的c(H+)≈c(HS-),而H2S的第二步电离平衡常数Kθa2(H2S)=$\frac{c({H}^{+})•c({S}^{2-})}{c(H{S}^{-})}$,而由于溶液中的c(H+)≈c(HS-),故Kθa2(H2S)≈c(S2-),故选D.
点评 本题考查了有关弱电解质的电离平衡常数的计算,难度不大,应注意的是多元弱酸电离分步进行,且以第一步为主.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
10.标准状况下V L氨气溶解在1L水中(水的密度为1g•mL-1),所得溶液密度为ρ g•mL-1,质量分数为w,物质的量浓度为c mol•L-1,则下列关系中不正确的是( )
| A. | w=$\frac{17c}{1000ρ}$ | B. | w=$\frac{17V}{17V+22400}$ | ||
| C. | c=$\frac{1000Vρ}{17V+22400}$ | D. | ρ=$\frac{17V+22400}{22.4+22.4V}$ |
4.化学与人类生产、生活密切相关,下列有关说法不正确的是( )
| A. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| B. | 漂白粉解决了氯水漂白时不稳定、难以保存、使用不方便、效果不理想的问题 | |
| C. | 钢铁的腐蚀最普遍的是吸氧腐蚀,最终产物为铁锈 | |
| D. | 温度、压强一定时,放热且熵增的反应能自发进行 |
11.下列说法借误的是( )
| A. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| B. | 近期出现在北方的雾霾是一种分散系,带活性炭口罩的原理是吸附作用 | |
| C. | 我国部分城市在推广使用的“甲醇汽油”有降低排放废气的优点,无任何负面作用 | |
| D. | 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜 |
8.已知:N2(g)+3H2(g)?2NH3(g)△H=-akJ•mol-1.一定条件下,现有容积相同且恒容的密闭容器甲与乙:①向甲中通入1mol N2和3mol H2,达到平衡时放出热量bkJ;②向乙中通入0.5mol N2和1.5mol H2,达到平衡时放出热量c kJ.则下列关系式正确的是( )
| A. | a>b>2c | B. | a=b<2c | C. | b=2c=a | D. | b=2c<a |
9.下列说法正确的是( )
| A. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| B. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| C. | 阳离子只有氧化性,阴离子只有还原性 | |
| D. | 氧化剂具有氧化性,还原剂具有还原性 |
 2,3,4-三甲基己烷,C9H20
2,3,4-三甲基己烷,C9H20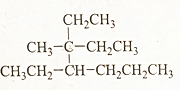 3-甲基-3,4-二乙基庚烷,C12H26.
3-甲基-3,4-二乙基庚烷,C12H26.