题目内容
3.实验室制乙烯的装置如下,有关说法正确的是( )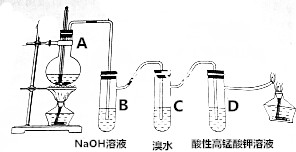
| A. | 乙烯中既有离子键又有共价键 | |
| B. | 装置B中的离子方程式:SO2+2OH-═SO42-+H2O | |
| C. | 装置C中乙烯发生取代反应生成氢溴酸,使溶液的酸性增强 | |
| D. | 装置D中溶液的紫色褪去,乙烯发生了氧化反应 |
分析 A.乙烯为共价化合物;
B.原子个数不守恒,二氧化硫与氢氧化钠反应生成亚硫酸钠和水;
C.乙烯与溴水发生加成反应;
D.乙烯含有碳碳双键,具有还原性.
解答 解:A.乙烯为共价化合物,只含有共价键,不含离子键,故A错误;
B.二氧化硫与氢氧化钠反应生成亚硫酸钠和水,离子方程式:SO2+2OH-═SO32-+H2O,故B错误;
C.乙烯与溴水发生加成反应,生成1,2-二溴乙烷,故C错误;
D.乙烯含有碳碳双键,具有还原性,能够被高锰酸钾氧化,使高锰酸钾褪色,故D正确;
故选:D.
点评 本题考查了乙烯的实验室制备及性质,熟悉乙烯制备原理及乙烯的结构是解题关键,题目难度不大.

练习册系列答案
相关题目
13.复盐M【K3Fe(A2B4)3•3H2O】可用于蓝色印刷和摄影,某小组同学将纯净的化合物M在一定条件下加热分解,对所得其他产物和固体产物进行实验和探究.
(1)Fe元素在周期表中的位置是第四周期第ⅤⅢ族,验证固体产物中存在钾元素的方法是做焰色反应实验,透过蓝色钴玻璃观察火焰的颜色呈紫色.
(2)经分析,所得其他产物由甲、乙和水蒸气组成,甲、乙转化关系如图(Ⅰ),转化时的能力变化如图(Ⅱ),已知A是形成化合物种类最多的元素,B是地壳中含量最多的元素,X、Y、甲、乙是含A、B两元素的单质或化合物,则化合物乙的电子式为 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.

(3)该小组同学已知固体产物中,铁元素不以三价形式存在,而盐也只有K2AB3,为了进一步确定复盐M的分解反应方程式,小组同学对固体产物进行定量测量.
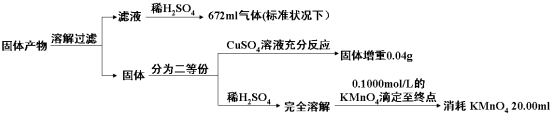
判断KMnO4(其还原产物为无色Mn2+溶液)溶液与试样反应到达滴定终点的现象为当加入最后一滴酸性高锰酸钾溶液时试样由无色变化为紫红色且振荡半分钟内部变化.由以上实验数据的分析可知,加热后所得固体产物中除K2AB3外还含有什么物质?它们之间的物质的量之比为多少?请把你的结论填入表中(可以不填满或补充空格).
(4)通过以上结论,复盐M加热分解的反应方程式为2K3Fe(C2O4)3•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3K2CO3+Fe+FeO+5CO2↑+4CO↑+6H2O.
(5)已知KHA2B4溶液呈酸性,向10mL0.01mol•L-1的H2A2O4溶液滴加0.01mol•L-1KOH溶液V(mL),下列叙述正确的是①②③.
①当V<10mL时,反应的离子方程式为H2A2B4+OH-=HA2B4++H2O
②当V=10mL时,溶液中C(HA2B4+)>C(H+)>C(A2B42-)>C(H2A2B4)
③当V=amL时,溶液中离子浓度的关系为c(K+)=2c(A2B42-)+c(HA2B4-)
若V=bmL时,溶液中离子浓度的关系为:c(K+)=c(A2B42-)+c(HA2B4-)+c(H2A2B4),则a>b.
(1)Fe元素在周期表中的位置是第四周期第ⅤⅢ族,验证固体产物中存在钾元素的方法是做焰色反应实验,透过蓝色钴玻璃观察火焰的颜色呈紫色.
(2)经分析,所得其他产物由甲、乙和水蒸气组成,甲、乙转化关系如图(Ⅰ),转化时的能力变化如图(Ⅱ),已知A是形成化合物种类最多的元素,B是地壳中含量最多的元素,X、Y、甲、乙是含A、B两元素的单质或化合物,则化合物乙的电子式为
 ,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
,写出反应X+Y→甲的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.6KJ/mol.
(3)该小组同学已知固体产物中,铁元素不以三价形式存在,而盐也只有K2AB3,为了进一步确定复盐M的分解反应方程式,小组同学对固体产物进行定量测量.

判断KMnO4(其还原产物为无色Mn2+溶液)溶液与试样反应到达滴定终点的现象为当加入最后一滴酸性高锰酸钾溶液时试样由无色变化为紫红色且振荡半分钟内部变化.由以上实验数据的分析可知,加热后所得固体产物中除K2AB3外还含有什么物质?它们之间的物质的量之比为多少?请把你的结论填入表中(可以不填满或补充空格).
| 固体产物中的成分 | K2AB3 | … | ||
| 物质的量之比 | ||||
(5)已知KHA2B4溶液呈酸性,向10mL0.01mol•L-1的H2A2O4溶液滴加0.01mol•L-1KOH溶液V(mL),下列叙述正确的是①②③.
①当V<10mL时,反应的离子方程式为H2A2B4+OH-=HA2B4++H2O
②当V=10mL时,溶液中C(HA2B4+)>C(H+)>C(A2B42-)>C(H2A2B4)
③当V=amL时,溶液中离子浓度的关系为c(K+)=2c(A2B42-)+c(HA2B4-)
若V=bmL时,溶液中离子浓度的关系为:c(K+)=c(A2B42-)+c(HA2B4-)+c(H2A2B4),则a>b.
11.下列化学实验事实及解释或者结论都正确的是( )
| A. | 将某气体燃烧,在火焰的上方罩一个冷而干燥的烧杯,烧杯内壁有水珠生成,再将烧杯立即倒转并加入澄清石灰水溶液震荡,石灰水变浑浊,则该气体一定是烃 | |
| B. | 除去乙酸乙酯中少量的乙酸,用饱和的碳酸钠溶液洗涤,然后分液、干燥、蒸馏 | |
| C. | 1ml 1%的NaOH溶液中加入2ml 2%的CuSO4溶液,振荡后再加入0.5ml淀粉的水解液,加热后未出现砖红色沉淀,说明淀粉尚未水解 | |
| D. | 乙酸和乙醇的酯化反应实验中,向试管中加入试剂的顺序是:浓硫酸、乙醇、冰醋酸 |
18.核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为:
已知: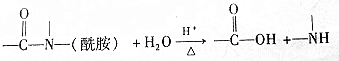
有关核黄素的下列说法中,正确的是( )

已知:
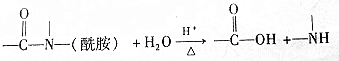
有关核黄素的下列说法中,正确的是( )
| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
8.用惰性电极电解250mL NaCl和CuSO4的混合溶液,经过一段时间后,两电极分别得到11.2L气体(不考虑气体溶解),下列叙述中不正确的是( )
| A. | 阴极上有Cu析出 | |
| B. | 阴极上产生的气体是氢气 | |
| C. | 阳极上产生的气体是氯气和氧气混合气体 | |
| D. | 使溶液恢复到原来状态,需加人适量CuO并通适量HC1气体 |
15.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24LNO和2.24LO2混合气体分子数为0.15NA | |
| C. | 加热条件,1molFe投入足量的浓硫酸,生成NA个SO2分子 | |
| D. | 0.1molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA |
16.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸反应 | B. | 灼热的木炭与CO2反应 | ||
| C. | 乙醇在氧气中燃烧 | D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
17.下列化学用语表达正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 甲烷分子的球棍模型: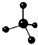 | ||
| C. | 乙醇的分子式:C2H5OH | D. | 氟离子的结构示意图: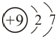 |