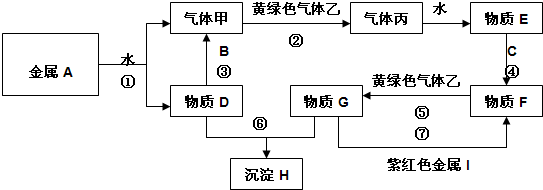
题目内容
 Ⅰ、A和B反应生成C,假定反应刚开始只有A、B,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则在这2min内反应的平均速率VA=
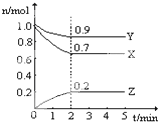
Ⅰ、A和B反应生成C,假定反应刚开始只有A、B,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则在这2min内反应的平均速率VA=Ⅱ、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如上图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为
(2)从开始至2min,Z的平均反应速率为
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:Ⅰ、根据v=
计算出2min内用物质A、B、C表示的平均反应速率,再利用速率之比等于化学计量数之比确定系数,书写化学反应方程式;
Ⅱ、(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=
计算反应速率v(Z);
| △c |
| △t |
Ⅱ、(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据v=
| △c |
| △t |
解答:
解:Ⅰ、v(A)=
=0.1 mol/(L?min),
v(B)=
=0.2 mol/(L?min),
v(C)=
=0.3 mol/(L?min),
所以,v(A):v(B):v(C)=0.1 mol?L-1?min-1:0.2 mol?L-1?min-1:0.3 mol?L-1?min-1=1:2:3,
化学计量数之比等于速率之比,反应方程式为A+2B=3C.
故答案为:0.1;0.3;A+2B=3C;
Ⅱ、(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y 2Z,
2Z,
故答案为:3X+Y 2Z;
2Z;
(2)在2min时间内,用Z表示反应的平均速率v(Z)=
=
=0.05mol/(L?min),
故答案为:0.05mol/?(L?min)..
| 1mol/L-0.8mol/L |
| 2min |
v(B)=
| 1mol/L-0.6mol/L |
| 2min |
v(C)=
| 0.6mol/L |
| 2min |
所以,v(A):v(B):v(C)=0.1 mol?L-1?min-1:0.2 mol?L-1?min-1:0.3 mol?L-1?min-1=1:2:3,
化学计量数之比等于速率之比,反应方程式为A+2B=3C.
故答案为:0.1;0.3;A+2B=3C;
Ⅱ、(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y
 2Z,
2Z,故答案为:3X+Y
 2Z;
2Z;(2)在2min时间内,用Z表示反应的平均速率v(Z)=
| △c(Z) |
| △t |
| ||
| 2min |
故答案为:0.05mol/?(L?min)..
点评:本题考查了反应速率的计算、化学平衡图象分析题目,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
下列说法正确的是( )
①除去二氧化硫中的少量三氧化硫可用98%的浓硫酸
②盛溴的试剂瓶里加少量水以减少溴的挥发
③钾、钠、白磷都应保存在水中
④做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用.
①除去二氧化硫中的少量三氧化硫可用98%的浓硫酸
②盛溴的试剂瓶里加少量水以减少溴的挥发
③钾、钠、白磷都应保存在水中
④做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用.
| A、①② | B、②④ | C、①③ | D、①②④ |
下列说法不正确的是( )
| A、1mol任何气体都含有NA个分子 |
| B、阿伏加德罗常数的“集体”就是1mol |
| C、摩尔是物质的量的单位,用于表示物质所含微粒多少 |
| D、阿伏加德罗常数的符号为NA,通常用6.02×1023表示 |
下列叙述不正确的是 ( )
| A、NH3是极性分子,为三角锥形 |
| B、双原子分子中的共价键,一定是非极性键 |
| C、非极性键也可能存在于离子化合物中 |
| D、CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央. |
下列有关立方烷(分子式:C8H8,结构简式: ),下列说法不正确的是( )
),下列说法不正确的是( )
 ),下列说法不正确的是( )
),下列说法不正确的是( )| A、分子中存在极性键、非极性键 |
| B、它含碳质量分数与乙炔、苯等物质相同 |
| C、它不是芳香烃,但与苯乙烯互为同分异构体 |
| D、它的一氯代物只有一种同分异构体,其二氯代物有两种同分异构体 |