题目内容
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,金属A的焰色为黄色,常温下金属单质B能与强碱反应,金属C在地壳中的含量居第四位.它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
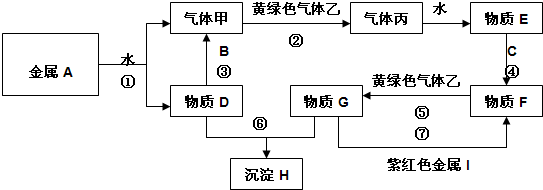
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:F 、丙
(2)写出反应③的化学方程式:
(3)写出反应⑤的离子方程式:
(4)物质F由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究物质F的变质情况,某化学兴趣小组的同学设计了下列实验方案.
①方案1:取少量F溶液,加入几滴 试剂(写化学式),如果观察到溶液变血红色,则证明F溶液已被氧化.
②方案2:取少量溶液,加入几滴 溶液(写化学式),如果观察到 ,则证明F溶液已完全被氧化.
③在配制F溶液时,为防止其被空气氧化,需加入少量某物质X,写出该反应的离子方程式 .
④F溶液中滴加D溶液的实验现象:
写出沉淀颜色变化的化学方程式: .

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:F
(2)写出反应③的化学方程式:
(3)写出反应⑤的离子方程式:
(4)物质F由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究物质F的变质情况,某化学兴趣小组的同学设计了下列实验方案.
①方案1:取少量F溶液,加入几滴
②方案2:取少量溶液,加入几滴
③在配制F溶液时,为防止其被空气氧化,需加入少量某物质X,写出该反应的离子方程式
④F溶液中滴加D溶液的实验现象:
写出沉淀颜色变化的化学方程式:
考点:无机物的推断
专题:推断题
分析:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.金属C在地壳中的含量居第四位,则C为Fe,与盐酸反应得到F,F与氯气反应得到G,G与氢氧化钠与得到红褐色沉淀H为Fe(OH)3,可知F为FeCl2,G为FeCl3,紫红色金属I与氯化铁反应得到氯化亚铁,则I为Cu,结合物质的性质解答该题.
解答:
解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.金属C在地壳中的含量居第四位,则C为Fe,与盐酸反应得到F,F与氯气反应得到G,G与氢氧化钠与得到红褐色沉淀H为Fe(OH)3,可知F为FeCl2,G为FeCl3,紫红色金属I与氯化铁反应得到氯化亚铁,则I为Cu,
(1)由上述分析可知,F为FeCl2、丙为HCl,故答案为:FeCl2;HCl;
(2)反应③是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)反应⑤是氯化亚铁与氯气反应生成氯化铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(4)物质FeCl2由于保存不妥或长久放置,容易被空气中的氧气氧化而变质,杂化中含有Fe3+,
①方案1:取少量F溶液,加入几滴KSCN溶液,如果观察到溶液变血红色,则证明F溶液已被氧化;
故答案为:KSCN;
②方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到溶液紫色不褪色,则证明F溶液已完全被氧化,
故答案为:酸性KMnO4;溶液紫色不褪色;
③在配制F溶液时,为防止其被空气氧化,需加入少量Fe,该反应的离子方程式为:2Fe3++Fe═3Fe2+;
故答案为:2Fe3++Fe═3Fe2+;
④氯化亚铁溶液中滴加NaOH溶液的实验现象为:生成白色沉淀,白色沉淀迅速转化为灰绿色,最好变成红褐色,沉淀颜色变化的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:生成白色沉淀,白色沉淀迅速转化为灰绿色,最好变成红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(1)由上述分析可知,F为FeCl2、丙为HCl,故答案为:FeCl2;HCl;
(2)反应③是Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)反应⑤是氯化亚铁与氯气反应生成氯化铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(4)物质FeCl2由于保存不妥或长久放置,容易被空气中的氧气氧化而变质,杂化中含有Fe3+,
①方案1:取少量F溶液,加入几滴KSCN溶液,如果观察到溶液变血红色,则证明F溶液已被氧化;
故答案为:KSCN;
②方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到溶液紫色不褪色,则证明F溶液已完全被氧化,
故答案为:酸性KMnO4;溶液紫色不褪色;
③在配制F溶液时,为防止其被空气氧化,需加入少量Fe,该反应的离子方程式为:2Fe3++Fe═3Fe2+;
故答案为:2Fe3++Fe═3Fe2+;
④氯化亚铁溶液中滴加NaOH溶液的实验现象为:生成白色沉淀,白色沉淀迅速转化为灰绿色,最好变成红褐色,沉淀颜色变化的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:生成白色沉淀,白色沉淀迅速转化为灰绿色,最好变成红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评:本题是无机框图推断题,考查物质推断与性质,难度中等,掌握元素化合物的性质是解题的关键,注意特殊的颜色与特殊反应是推断的突破口.

练习册系列答案
相关题目
下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7 ②用HF溶液做导电性实验,灯泡很暗
③HF溶液与NaCl溶液不能发生反应 ④常温下0.1mol/L的HF溶液的pH为2.3.
①常温下NaF溶液的pH大于7 ②用HF溶液做导电性实验,灯泡很暗
③HF溶液与NaCl溶液不能发生反应 ④常温下0.1mol/L的HF溶液的pH为2.3.
| A、①②③ | B、①②④ |
| C、①②③④ | D、①④ |
NA表示阿伏加德罗常数,下列判断正确的是( )
| A、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| B、常温常压下,22.4LCO2中含有的CO2分子数小于NA个 |
| C、等物质的量的N2和CO的质量均为28g |
| D、常温下,1L 0.1mol/LNa2CO3溶液中,含有阴离子的总数小于0.1NA |
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O═SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
下列有关说法错误的是( )
①SO2+2Fe3++2H2O═SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O
下列有关说法错误的是( )
| A、氧化性Cr2O72->Fe3+>SO2 |
| B、能将Na2SO3氧化成Na2SO4 |
| C、每有1 mol K2Cr2O7参加反应,转移电子的数目为3NA |
| D、若6.72 L SO2(标准状况)参加反应,则最终消耗0.1 mol K2Cr2O7 |

 元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含Po)的部分知识如下表所示,
元素周期律是指导我们学习元素及其化合物知识的重要工具.已知氧族元素(不含Po)的部分知识如下表所示, Ⅰ、A和B反应生成C,假定反应刚开始只有A、B,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则在这2min内反应的平均速率VA=
Ⅰ、A和B反应生成C,假定反应刚开始只有A、B,它们的起始浓度均为1mol/L.反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L.则在这2min内反应的平均速率VA=