题目内容
4.一水硫酸四氨合铜(Ⅱ)[Cu(NH3)4]SO4•H2O是一种重要的染料及农药中间体.请回答下列相关问题:(1)Cu2+基态时的核外电子排布式为1s22s22p63s23p63d9.
(2)NH${\;}_{4}^{+}$的立体构型是正四面体,其中心原子的杂化方式为sp3.
(3)[Cu(NH3)4]SO4•H2O制备过程如下:
向CuSO4溶液中逐滴加入氨水,刚开始时看到现象是出现蓝色沉淀;有关反应化学方程式为CuSO4+2NH3•H2O=Cu(OH)2↓+(NH4)2SO4;继续滴加氨水,又看到蓝色沉淀消失,变为深蓝色溶液;有关反应的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;出现此种现象的原因是生成了[Cu(NH3)4]2+,写出该离子的结构简式(必须将配位键表示出来)
 ;再加入无水酒精又看到的现象是
;再加入无水酒精又看到的现象是析出深蓝色晶体,无水酒精的作用是降低一水硫酸四氨合铜在水中的溶解度,便于结晶析出. 如果把酒精蒸汽通过盛有灼热氧化铜的直玻璃管,写出反应的化学方程式CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
分析 (1)Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p43d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+;
(2)NH4+中,N原子成4个N-H,采取sp3杂化,不含孤对电子,为正四面体结构;
(3)向CuSO4溶液中逐滴加入氨水,刚开始时生成氢氧化铜沉淀,据此写出反应方程式并判断反应现象;继续滴加氨水,氢氧化铜溶解生成[Cu(NH3)4]2+,则氢氧化铜蓝色沉淀消失,变为深蓝色溶液;[Cu(NH3)4]2+中铜离子含有空轨道、水分子中O原子含有孤电子对,二者形成配位键,配位键由含有孤电子对的原子指向含有空轨道的原子,据此画出其结构简式;乙醇能够降低一水硫酸四氨合铜在水中的溶解度,加入乙醇后会观察到析出深蓝色晶体;在加热条件下乙醇与氧化铜发生氧化还原反应生成乙醛、铜和水,据此写出反应的化学方程式.
解答 解:(1)Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p63d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+,Cu2+的核外电子排布式为:1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(2)NH4+中,N原子成4个N-H,采取sp3杂化,铵根离子中不含孤对电子,所以铵根离子为正四面体结构,
故答案为:正四面体;sp3;
(3)向CuSO4溶液中逐滴加入氨水,刚开始时生成氢氧化铜沉淀,反应方程式为:CuSO4+2NH3•H2O=Cu(OH)2↓+(NH4)2SO4,所以会看到出现蓝色沉淀;继续滴加氨水,氢氧化铜发生反应:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,则氢氧化铜蓝色沉淀消失,变为深蓝色溶液;[Cu(NH3)4]2+中铜离子含有空轨道、水分子中O原子含有孤电子对,二者形成配位键,配位键由含有孤电子对的原子指向含有空轨道的原子,则该配离子为 ;
;
由于乙醇能够降低一水硫酸四氨合铜在水中的溶解度,则加入乙醇后会观察到析出深蓝色晶体;
如果把酒精蒸汽通过盛有灼热氧化铜的直玻璃管,二者发生氧化还原反应,反应的化学方程式为:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O,
故答案为:出现蓝色沉淀;CuSO4+2NH3•H2O=Cu(OH)2↓+(NH4)2SO4;蓝色沉淀消失,变为深蓝色溶液;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-; ;析出深蓝色晶体;降低一水硫酸四氨合铜在水中的溶解度,便于结晶析出;CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
;析出深蓝色晶体;降低一水硫酸四氨合铜在水中的溶解度,便于结晶析出;CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O.
点评 本题考查了原子核外电子排布、配合物成键情况,题目难度中等,注意掌握原子核外电子派排布式书写方法,明确分析配合物成键情况的方法,试题培养了学生的分析能力及灵活应用能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案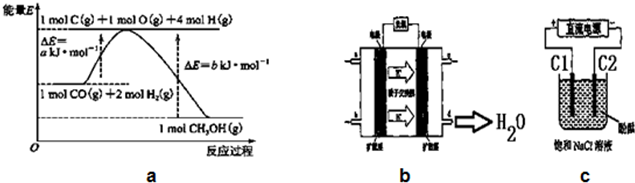
(1)写出合成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-(b-a)KJ/mol.
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)在500℃达到平衡时,平衡常数K=25.
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为80%.
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响,无影响.(填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式O2+4e-+4H+=2H2O.
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).
①该反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
②电解开始后在电极C2的周围(填“C1”或“C2”)先出现红色.

实验药品:铜,铁,镁,0.5mol/L H2SO4,2mol/L H2SO4,18.4mol/L H2SO4
Ⅰ.甲同学研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为分别投入大小、形状相同的Cu、Fe、Mg.
(2)甲同学的实验目的是探究反应物本身的性质对反应速率的影响;要得出正确的实验结论,还需控制的实验条件是温度相同.
Ⅱ.乙同学为了更精确的研究浓度对反应速率的影响,利用右图所示装置进行实验,
(3)乙同学在实验中应该测定的数据是一定时间内产生气体的体积(或产生一定体积的气体所需的时间).
(4)乙同学完成该实验应选用的实验药品镁(或铁)和0.5mol/LH2SO4、2mol/LH2SO4.
(5)图中仪器A的名称是分液漏斗,检验该装置气密性的方法是按住注射器活塞不动,向分液漏斗中倒水,液面高度不变,说明装置气密性良好.
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
| A. | 在标准状况下,1 mol水的体积约为22.4L | |
| B. | 只有在标准状况下,气体的摩尔体积才是22.4mol/L | |
| C. | 在标准状况下,1molH2和O2的混合气体体积约为22.4 L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L/mol |
| A. | 铁与稀硫酸反应制取H2后的溶液中:Na+、K+、AlO2-、Br- | |
| B. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| C. | 苯酚钠溶液:H+、HCO3-、SO2、K+ | |
| D. | 氢氧化铝胶体:H+、K+、S2-、SO32- |


