题目内容
从加热氯酸钾与MnO2的混合物制氧气后的剩余物中回收二氧化锰的操作顺序正确的是( )
| A、溶解、过滤、蒸发、洗涤 |
| B、溶解、过滤、洗涤、烘干 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、洗涤、过滤、烘干 |
考点:物质的分离、提纯的基本方法选择与应用,物质的分离、提纯和除杂
专题:化学实验基本操作
分析:氯酸钾易溶于水,氯酸钾受热分解生成的氯化钾易溶于水,二氧化锰不溶于水,根据氯酸钾、氯化钾、二氧化锰的水溶性,选择从反应后的剩余固体中回收催化剂二氧化锰的方法,以此解答该题.
解答:
解:反应后的剩余固体中,一定含有二氧化锰和氯化钾,可能含有氯酸钾;
先加入足量的水,氯化钾溶于水形成溶液,如果含有氯酸钾时,氯酸钾溶于水形成溶液,而二氧化锰不溶于水;
再过滤,把二氧化锰从溶液中分离出来;
再对二氧化锰进行洗涤,除去二氧化锰中的杂质;
再烘干二氧化锰,得到纯净的二氧化锰,
故选B.
先加入足量的水,氯化钾溶于水形成溶液,如果含有氯酸钾时,氯酸钾溶于水形成溶液,而二氧化锰不溶于水;
再过滤,把二氧化锰从溶液中分离出来;
再对二氧化锰进行洗涤,除去二氧化锰中的杂质;
再烘干二氧化锰,得到纯净的二氧化锰,
故选B.
点评:本题考查物质的分离提纯方法和选择,为高频考点,侧重于学生的分析能力和实验设计的能力,题目难度中等,解答本题的关键是把握相关物质的性质,学习中注意积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于乙烯的说法中错误的是( )
| A、乙烯可以催熟植物的果实 |
| B、乙烯可以与水发生加成反应 |
| C、乙烯分子的空间构型是正四面体 |
| D、使用溴水或KMnO4 溶液,都可以鉴别乙烯和乙烷 |
从柑橘中提取得到结构简式如下图所示的化合物,则下列有关它的推断错误的是( )


| A、分子式为C10H16 |
| B、常温下呈固态,比水重 |
| C、其一氯代物有8种 |
| D、能与溴水发生加成反应 |
在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )
| 1 |
| 2 |
| A、m+n>p |
| B、平衡向逆反应方向移动 |
| C、A的转化率提高 |
| D、C的体积分数增加 |
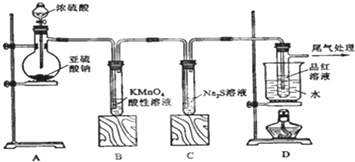

 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
