题目内容
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
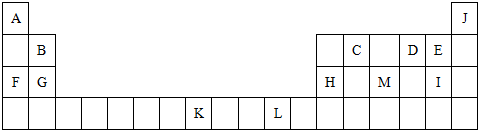
试回答下列问题:
(1)表中所列的字母代表元素属于d区的元素有 (填元素名称).
(2)写出元素L的基态原子的价电子排布式 .
(3)写出CD2所代表物质电子式 ,其中心原子采用的杂化方式为
(4)上表中字母C2A2所代表物质含有 个σ键, 个π键
(5)写出上表中字母K所代表元素的原子结构示意图
(6)要证明太阳上是否含有J元素,可采用的方法是 .
(7)在C2H4、CH3Cl、HCHO、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有 (填分子式)

试回答下列问题:
(1)表中所列的字母代表元素属于d区的元素有
(2)写出元素L的基态原子的价电子排布式
(3)写出CD2所代表物质电子式
(4)上表中字母C2A2所代表物质含有
(5)写出上表中字母K所代表元素的原子结构示意图
(6)要证明太阳上是否含有J元素,可采用的方法是
(7)在C2H4、CH3Cl、HCHO、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知A为氢、B为Be、C为碳、D为氧、E为氟、F为Na、G为Mg、H为Al、M为磷、I为Cl、K为Fe、L为Cu.
(1)d区元素包含周期表中3至10列元素(镧系元素、锕系元素除外);
(2)L元素处于第四周期IB族;
(3)CO2分子中碳原子与氧原子之间形成2对共用电子对,结合C成2个σ键,没有孤电子对,据此确定碳原子的杂化方式;
(4)C2H2的结构简式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键;
(5)Fe元素核外电子数为26,有4个电子层,各层电子数为2、8、14、2;
(6)要证明太阳上是否含有J元素,需对太阳光进行光谱分析;
(7)确定碳原子σ键数目、孤电子对数,结合分子空间构型,确定碳原子采取杂化方式.
(1)d区元素包含周期表中3至10列元素(镧系元素、锕系元素除外);
(2)L元素处于第四周期IB族;
(3)CO2分子中碳原子与氧原子之间形成2对共用电子对,结合C成2个σ键,没有孤电子对,据此确定碳原子的杂化方式;
(4)C2H2的结构简式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键;
(5)Fe元素核外电子数为26,有4个电子层,各层电子数为2、8、14、2;
(6)要证明太阳上是否含有J元素,需对太阳光进行光谱分析;
(7)确定碳原子σ键数目、孤电子对数,结合分子空间构型,确定碳原子采取杂化方式.
解答:
解:由元素在周期表中位置,可知A为氢、B为Be、C为碳、D为氧、E为氟、F为Na、G为Mg、H为Al、M为磷、I为Cl、K为Fe、L为Cu.
(1)d区元素包含周期表中3至10列元素(镧系元素、锕系元素除外),故上述元素中Fe处于d区,故答案为:铁;
(2)L元素处于第四周期IB族,基态原子的价电子排布式为:3d104s1,故答案为:3d104s1;
(3)CO2分子中碳原子与氧原子之间形成2对共用电子对,电子式为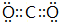 ,C原子成2个σ键,没有孤电子对,碳原子的杂化方式为sp,
,C原子成2个σ键,没有孤电子对,碳原子的杂化方式为sp,
故答案为: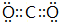 ;sp;
;sp;
(4)C2H2的结构简式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键,故分子中含有3个σ键、2个π键,故答案为:3;2;
(5)Fe元素核外电子数为26,有4个电子层,各层电子数为2、8、14、2,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(6)要证明太阳上是否含有J元素,需对太阳光进行光谱分析,故答案为:对太阳光进行光谱分析;
(7)C2H4、HCHO中C原子成3个σ键,没有孤电子对,C原子采取sp2杂化;CH3Cl、CCl4甲烷四面体构型,C原子成4个σ键,没有孤电子对,C原子采取sp3杂化;CS2为直线型结构,C原子采取sp杂化,故答案为:C2H4、HCHO.
(1)d区元素包含周期表中3至10列元素(镧系元素、锕系元素除外),故上述元素中Fe处于d区,故答案为:铁;
(2)L元素处于第四周期IB族,基态原子的价电子排布式为:3d104s1,故答案为:3d104s1;
(3)CO2分子中碳原子与氧原子之间形成2对共用电子对,电子式为
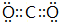 ,C原子成2个σ键,没有孤电子对,碳原子的杂化方式为sp,
,C原子成2个σ键,没有孤电子对,碳原子的杂化方式为sp,故答案为:
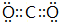 ;sp;
;sp;(4)C2H2的结构简式为H-C≡C-H,单键为σ键,三键含有1个σ键、2个π键,故分子中含有3个σ键、2个π键,故答案为:3;2;
(5)Fe元素核外电子数为26,有4个电子层,各层电子数为2、8、14、2,原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(6)要证明太阳上是否含有J元素,需对太阳光进行光谱分析,故答案为:对太阳光进行光谱分析;
(7)C2H4、HCHO中C原子成3个σ键,没有孤电子对,C原子采取sp2杂化;CH3Cl、CCl4甲烷四面体构型,C原子成4个σ键,没有孤电子对,C原子采取sp3杂化;CS2为直线型结构,C原子采取sp杂化,故答案为:C2H4、HCHO.
点评:本题是对物质结构的考查,涉及元素周期表、核外电子数排布、电子数、杂化轨道等,难度不大,需要具备扎实的基础知识.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、碳酸钙与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| B、铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+ |
| C、氢氧化镁溶于盐酸:Mg(OH)2+2H+=Mg2++2H2O |
| D、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
从加热氯酸钾与MnO2的混合物制氧气后的剩余物中回收二氧化锰的操作顺序正确的是( )
| A、溶解、过滤、蒸发、洗涤 |
| B、溶解、过滤、洗涤、烘干 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、洗涤、过滤、烘干 |
下列关于萃取操作说法正确的是( )
| A、从碘水中萃取碘,可选用酒精作为萃取剂 |
| B、萃取时所选溶剂应与原溶剂互不相溶,且与溶质不反应 |
| C、萃取后,静置分层,下层液体流出后,打开活塞,用另一只烧杯盛接剩余液体 |
| D、用四氯化碳萃取碘,静置后,上层接近无色,下层为紫红色 |
利用碳酸钠晶体(Na2CO3?10H2O)来配制0.5mol?L-1的碳酸钠溶液1 000mL,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
| A、称取碳酸钠晶体100 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 |
| D、定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线 |
下列说法正确的是( )
A、已知1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化如图1,则NO2和CO反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g);△H=+234kJ/mol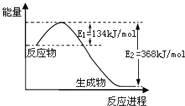 | ||||||||
B、一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| ||||||||
| C、已知CaCO3的Ksp=2.8×10-9,现将等体积的Na2CO3溶液与CaBr2溶液混合,若CaBr2溶液浓度为 5.6×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为 5×10-5 mol/L | ||||||||
D、在不同条件下进行的异构化反应 X?Y 的进程图解如下.图2中的“ ”是X,“ ”是X,“ ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小 ”是Y,则可以计算得到乙的平衡常数K=1,且比甲的平衡常数要小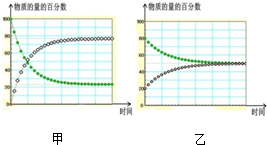 |
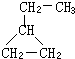 可表示为
可表示为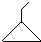 ,则金刚乙烷、金刚乙胺的结构简式可用下图表示.
,则金刚乙烷、金刚乙胺的结构简式可用下图表示.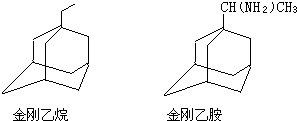
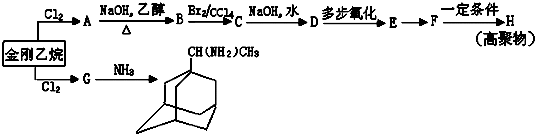
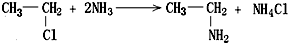
 ,如金刚乙烷表示为R-CH2CH3)
,如金刚乙烷表示为R-CH2CH3)