题目内容
在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.2mol?L-1,SO42-浓度为0.6mol?L-1,则混合溶液中Na+的浓度为( )
| A、0.6mol?L-1 |
| B、0.15mol?L-1 |
| C、0.3mol?L-1 |
| D、0.45mol?L-1 |
考点:物质的量浓度的相关计算
专题:守恒法
分析:由电荷守恒可知,溶液中阳离子的电荷总数等于阴离子的电荷总数,以此来解答.
解答:
解:Al3+浓度为0.2mol?L-1,SO42-浓度为0.6mol?L-1,设Na+的浓度为x,
由电荷守恒可知,
x+0.2×3=0.6×2,
解得x=0.6mol/L,
故选A.
由电荷守恒可知,
x+0.2×3=0.6×2,
解得x=0.6mol/L,
故选A.
点评:本题考查物质的量浓度的计算,为高频考点,把握电荷守恒为解答的关键,注意电荷总数计算中应乘以相应的电荷数,侧重分析能力和计算能力的考查,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
用一定体积、一定浓度的盐酸跟过量的锌反应制取一定体积的氢气,为了提高化学反应速率而又不影响生成氢气的体积,下列措施中合理的是( )
| A、加少量稀硫酸 |
| B、加少量的氯化钠溶液 |
| C、加蒸馏水 |
| D、加少量硫酸铜 |
下列烯烃和HBr发生加成反应所得产物有同分异构体的是( )
| A、CH2═CH2 |
| B、H3CH═CHCH3 |
C、 |
| D、CH3CH2CH=CH2 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、能使KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- |
| B、常温下,强酸性溶液中:Na+、NH4+、ClO-、I- |
| C、滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42- |
| D、能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- |
下列实验能达到实验目的是( )
A、 验证化学能转化为电能 |
B、 探究温度对平衡移动的影响 |
C、 验证铁发生析氢腐蚀 |
D、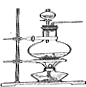 用MnO2与H2O2制取Cl2 |
下列说法正确的是( )
| A、15 g乙烷所含极性共价键的数目为3×6.02×1023 |
| B、0.1 mol 甲基含有的质子数6.02×1023 |
| C、常温下,100 mL 0.1mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023 |
| D、0.5 mol 乙醇完全燃烧时,转移的电子数为3×6.02×1023 |
下列离子组中,能够在溶液中共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是 ( )
| A、Na+、Fe2+、Cl-、SO42- |
| B、Ba2+、K+、CO32-、Cl- |
| C、Al3+、Ca2+、Cl-、NO3- |
| D、Na+、Ba2+、NO3-、HCO3- |