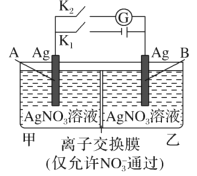
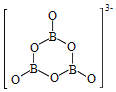
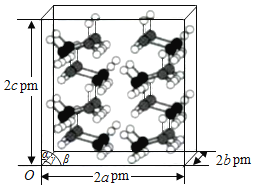
题目内容
【题目】某可逆反应从0—2分钟进行过程中, 在不同反应时 间各物质的量的变化情况如下图所示。则该反应的的反应物是______,生成物是_______,化学方程式为_____________________________;反应开始至2分钟时,能否用C表示反应速率?若能,其反应速率为______________,若不能,则其原因为________________________________________________________;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了___________状态。
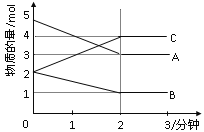
【答案】A B 2A+B2C 不能 无体积,无法求出浓度变化值 平衡
【解析】
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,则该反应的反应物是A、B,生成物为C,图象中物质的量的变化之比,等于化学方程式计量数之比,计算得到反应物和生成物变化量之比=n(A):n(B):n(C)=(5mol-3mol):(2mol-1mol):(4mol-2mol)=2:1:2,反应为可逆反应,反应的化学方程式:2A+B2C;随反应进行进行2min后A、B、C物质的量不变,说明反应达到平衡状态,正逆反应速率相同,反应是可逆反应;反应开始至2分钟时,可以求出C的变化量,但是题目中没有给定密闭容器的体积,无法求出C物质的变化的浓度,就不能计算出C的反应速率;
故答案为:A、B;2A+B2C;不能;无体积,无法求出浓度变化值;平衡。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】已知:①(![]() +HNO3
+HNO3![]()
![]() +H2O △H<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
+H2O △H<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
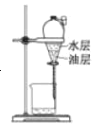
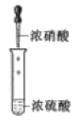
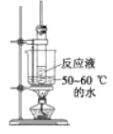
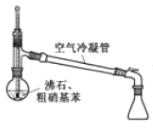
目的 | 分液 | 配制混酸 | 水浴加热 | 蒸馏提纯 |
A.AB.BC.CD.D
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以确保化学实验的绿色化。
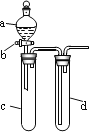
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL的浓硝酸。反应一段时间后,再由a向c中加2 mL蒸馏水,c中的实验现象有什么变化___________。
方案 | 甲 | 乙 | 丙 |
反应物 | Cu、浓HNO3 | Cu、稀HNO3 | Cu、O2、稀HNO3 |
(3)如表所示是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________,理由是________________________________________________________________________。