题目内容
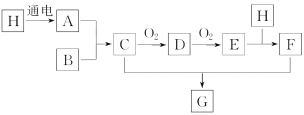
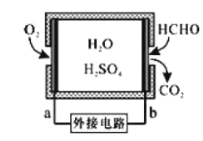
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 molL1 的AgNO3溶液,乙池为1 molL1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是
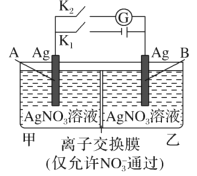
A.实验开始先断开K1,闭合K2,此时![]() 向B电极移动
向B电极移动
B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
【答案】C
【解析】
A. 实验开始先断开K1,闭合K2,甲池中硝酸根浓度大,氧化性强,则A为正极,B为负极,根据原电池“同性相吸”原理,得到此时![]() 向B电极移动,故A正确;
向B电极移动,故A正确;
B. 断开K1,闭合K2,一段时间后电流计指针归零,左右两边硝酸根浓度相等,根据溶液呈电中性,因此两池银离子浓度相等,故B正确;
C. 当电流计指针归零后,断开K2闭合K1一段时间后,B电极为阳极,银质量消耗,因此B电极的质量减小,故C错误;
D. 当电流计指针归零后,断开K2闭合K1,B为阳极,银失去电子变为银离子,甲池中的硝酸根离子不断向乙池移动,因此乙池溶液浓度增大,故D正确。
综上所述,答案为C。

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目