题目内容
【题目】工业制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+ NaHCO3↓。完成下列填空:
(1)上述反应体系中出现的几种短周期元素,非金属性最强的是_____,第二周期原子半径由大到小的是______。
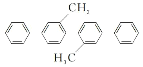
(2)反应体系中出现的非金属元素可形成多种化合物 ,其中和铵根离子空间构型相同且属于有机物的电子式是______,该分子为_____( 选填“极性”、“非极性”)分子。
(3)写出上述元素中有三个未成对电子的原子核外电子排布式_____,下列关于该元素和氧元素之间非金属性大小判断依据正确的是____(填编号)
a.最高价氧化物对应水化物的酸性 b.两元素形成化合物的化合价
c.气态氢化物的稳定性 d. 氢化物水溶液的酸碱性
(4)有人设想冰的晶胞也应该类似于金刚石,但实际较为复杂,可能是因为氢键较弱而导致“饱和性和方向性”很难被严格执行。例如:有文献报道氨晶体中每个氢原子都形成氢键,则每个NH3与周围______个NH3通过氢键相结合。
(5)化合物 FeF3熔点高于1000℃,而Fe(CO)5 的熔点却低于 0℃,FeF3熔点远高于Fe(CO)5的原因可能是_____________。
【答案】O C>N>O ![]() 非极性 1s22s22p3 bc 6 FeF3是离子晶体,Fe(CO)5是分子晶体,离子键的作用力远比分子间作用力强,故FeF3熔点远高于Fe(CO)5
非极性 1s22s22p3 bc 6 FeF3是离子晶体,Fe(CO)5是分子晶体,离子键的作用力远比分子间作用力强,故FeF3熔点远高于Fe(CO)5
【解析】
氧的电负性最大,同周期从左到右半径逐渐减小;甲烷分子具有中心对称;根据非金属强弱思维进行分析;FeF3是离子晶体,Fe(CO)5是分子晶体。
(1)上述反应体系中出现的几种短周期元素,分别是H、C、N、O、Na,氧的电负性最大,因此非金属性最强的是O,同周期从左到右半径逐渐减小,因此第二周期原子半径由大到小的是C>N>O;故答案为:O;C>N>O。
(2)反应体系中出现的非金属元素可形成多种化合物 ,其中和铵根离子空间构型相同且属于有机物的是甲烷,其电子式是![]() ,甲烷分子具有中心对称,因此该分子为非极性分子;故答案为:
,甲烷分子具有中心对称,因此该分子为非极性分子;故答案为:![]() ;非极性。
;非极性。
(3)写出上述元素中有三个未成对电子的原子是N,N的核外电子排布式1s22s22p3,a. N最高价氧化物对应水化物是硝酸,O无最高价氧化物对应水化物,因此a错误;b. 两元素形成化合物的化合价,O显负价,氧非金属性更强,故b正确;c. 简单气态氢化物的稳定性越强,非金属性越强,故c正确;d. 氢化物水溶液的酸碱性无法比较非金属性强弱,故d错误;故答案为:1s22s22p3;bc。
(4)氨晶体中每个氢原子都形成氢键,并且考虑氢键饱和性和方向性出现与理论的偏差,氨晶体中,每个N原子的孤对电子接受分属其他氨分子的3个氢原子,一个氨气本身3个氢必然和其他的氨气的氮之间形成氢键,因此则每个NH3与周围6个NH3通过氢键相结合;故答案为:6。
(5)化合物FeF3熔点高于1000℃,而Fe(CO)5的熔点却低于0℃,FeF3熔点远高于Fe(CO)5的原因可能是FeF3是离子晶体,Fe(CO)5是分子晶体,离子键的作用力远比分子间作用力强,故FeF3熔点远高于Fe(CO)5;FeF3是离子晶体,Fe(CO)5是分子晶体,离子键的作用力远比分子间作用力强,故FeF3熔点远高于Fe(CO)5。

 阅读快车系列答案
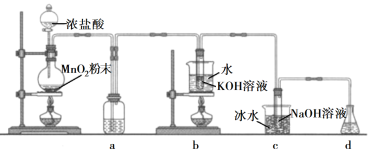
阅读快车系列答案【题目】实验室用少量的溴和足量的乙醇制备1,2一二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1.2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g/cm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
请按要求回答下列问题:
(1)写出A装置中的化学反应方程式_____;
(2)装置C中盛有氢氧化钠溶液,其作用是_____
(3)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____
(4)判断该制备反应已经结束的最简单方法是_____;
(5)若产物中有少量未反应的Br2,最好用_____洗涤除去;(填正确选项前的字母)
a 水 b 亚硫酸氢钠 c 碘化钠溶液 d 乙醇
(6)反应过程中应用冷水冷却装置D,其主要目的是_____;但又不能过度冷却(如用冰水),其原因是_____.
【题目】天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 | C2H6(g) | C2H4(g) | H2(g) |
燃烧热ΔH/( kJ·mol1) | -1560 | -1411 | -286 |
①ΔH=_________kJ·mol1。
②提高该反应平衡转化率的方法有_________、_________。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4![]() C2H6+H2。反应在初期阶段的速率方程为:r=k×
C2H6+H2。反应在初期阶段的速率方程为:r=k×![]() ,其中k为反应速率常数。
,其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_____ r1。
②对于处于初期阶段的该反应,下列说法正确的是_________。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
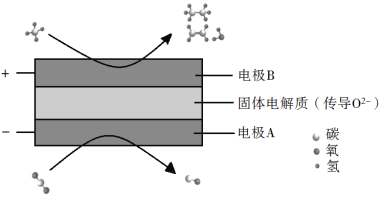
①阴极上的反应式为_________。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为_________。