题目内容
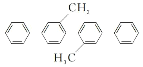
【题目】已知:①(![]() +HNO3
+HNO3![]()
![]() +H2O △H<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
+H2O △H<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
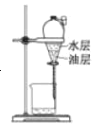
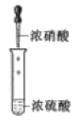
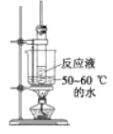
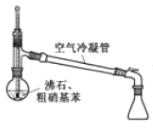
目的 | 分液 | 配制混酸 | 水浴加热 | 蒸馏提纯 |
A.AB.BC.CD.D
【答案】A
【解析】
A.硝基苯的密度比水的密度大,不溶于水,可用分液分离,分层后水在上层、油层在下层,故A正确;
B.浓硫酸密度比浓硝酸密度大,为了使液体充分混合,混合时应将密度大的液体注入密度小的液体中,即应将浓硫酸注入浓硝酸中,故B错误;
C.该反应中需要控制反应温度,图示装置缺少温度计,故C错误;
D.蒸馏时温度计测定馏分的温度,图示温度计水银球未在支管口处,且锥形瓶不能密封,故D错误;
故答案为A。

【题目】天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)= C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 | C2H6(g) | C2H4(g) | H2(g) |
燃烧热ΔH/( kJ·mol1) | -1560 | -1411 | -286 |
①ΔH=_________kJ·mol1。
②提高该反应平衡转化率的方法有_________、_________。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4![]() C2H6+H2。反应在初期阶段的速率方程为:r=k×
C2H6+H2。反应在初期阶段的速率方程为:r=k×![]() ,其中k为反应速率常数。
,其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_____ r1。
②对于处于初期阶段的该反应,下列说法正确的是_________。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
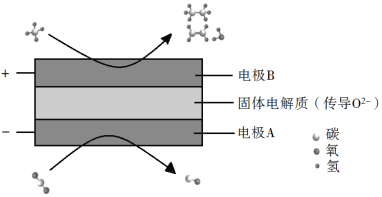
①阴极上的反应式为_________。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为_________。