题目内容
3. 乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:回答下列问题:
乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:回答下列问题:(1)F的结构式CH2=CH2
(2)B的化学名称是乙酸乙酯;
(3)由乙醇生产C的化学反应类型为CH3CH2OH+Cl2 $\stackrel{光照}{→}$CH2ClCH2OH+HCl.
(4)写出C到D的反应方程式CH2ClCH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCl+H2O
(5)由乙醇生成G的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O.
分析 乙醇在浓硫酸加热的条件下发生消去反应得F为CH2=CH2,根据G的分子式可知,乙醇与氧气发生氧化得G为CH3CHO,根据A的分子式可知,乙醇氧化得A为CH3COOH,A与乙醇发生酯化反应得B为CH3COOCH2CH3,乙醇与氯气发生取代反应得C为CH2ClCH2OH,C在浓硫酸的作用下发生消去反应得D为CH2=CHCl,D发生加聚反应得E为 ,据此分析解答.
,据此分析解答.
解答 解:乙醇在浓硫酸加热的条件下发生消去反应得F为CH2=CH2,根据G的分子式可知,乙醇与氧气发生氧化得G为CH3CHO,根据A的分子式可知,乙醇氧化得A为CH3COOH,A与乙醇发生酯化反应得B为CH3COOCH2CH3,乙醇与氯气发生取代反应得C为CH2ClCH2OH,C在浓硫酸的作用下发生消去反应得D为CH2=CHCl,D发生加聚反应得E为 ,
,
(1)根据上面的分析可知,F的结构式为CH2=CH2,
故答案为:CH2=CH2;
(2)B为CH3COOCH2CH3,B的化学名称是乙酸乙酯,
故答案为:乙酸乙酯;
(3)由乙醇生产C的化学反应类型为CH3CH2OH+Cl2 $\stackrel{光照}{→}$CH2ClCH2OH+HCl,
故答案为:CH3CH2OH+Cl2 $\stackrel{光照}{→}$CH2ClCH2OH+HCl;
(4)C到D的反应方程式为CH2ClCH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCl+H2O,
故答案为:CH2ClCH2OH$→_{△}^{浓H_{2}SO_{4}}$CH2=CHCl+H2O;
(5)由乙醇生成G的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O.
点评 本题考查有机物推断,为高频考点,以A为突破口结合反应条件进行推断,熟悉常见有机物结构简式、官能团及其性质关系,题目难度不大.

| A. | pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合,混合后溶液pH=7 | |
| B. | 将0.1mol•L-1氢氧化钠溶液与pH=1稀硫酸等体积混合,混合后的溶液pH<7 | |
| C. | 硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | pH相同的醋酸钠溶液、碳酸氢钠溶液、碳酸钠溶液,其物质的量浓度: c(CH3COONa)>c(NaHCO3)>c(Na2CO3) |
| 元素 | 相关信息 |
| X | X元素可形成自然界中硬度最大的物质 |
| Y | 其单质为双原子分子,其最简单氢化物的水溶液能使酚酞变红 |
| Z | Z是短周期内最容易失去电子的元素 |
| M | M的一种同位素的质量数为34,中子数为18 |
| N | N是具有紫红色光泽的金属,有很好的延展性、导热性和导电性 |
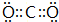 .
.(2)标准状况下,将4.48L X的最高价氧化物通入1L 0.3mol•L-1 Z的最高价氧化物对应水化物的溶液中发生反应的离子方程式为3OH-+2CO2=HCO3-+CO32-+H2O.
(3)Y的氢化物Y2H4是火箭的常见燃料,已知16.0g该液态燃料在氧气中完全燃烧生成氮气和液态水时,放出312kJ热量.写出该反应的热化学方程式:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624 kJ•mol-1.
(4)元素N与人体分泌物中的盐酸以及空气反应可生成超氧酸(HO2):N+HCl+O2═NCl+HO2,HO2不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列有关该反应的说法错误的是C.
A.氧化剂是O2
B.HO2在碱中不能稳定存在
C.氧化产物是HO2
D.1mol N参加反应就有1mol电子发生转移
(5)Y、Z两元素形成的化合物H可用于汽车的安全气囊,取6.5g H充分撞击分解后得到两种单质,其中一种气体单质的体积在标准状况下为3.36L,则H的化学式为NaN3,该物质的晶体类型为离子晶体.
| A. | 同质量的H2与Cl2,H2的分子数一定比Cl2多 | |
| B. | 0.5mol氢的质量是0.5g | |
| C. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| D. | 0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
 CO2和CO是工业排放的对环境产生影响的废气.
CO2和CO是工业排放的对环境产生影响的废气.(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);△H=-159.47kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g);△H=a kJ•mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);△H=-86.98kJ•mol-1
则a为+72.49kJ.mol-1.
(2)科学家们提出用工业废气中的CO2制取甲醇:CO2+3H2CH3OH+H2O.
制得的CH3OH可用作燃料电池的燃料.
①在KOH介质中,负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②作介质的KOH可以用电解K2SO4溶液的方法制得.则KOH在D出口得到,阳极的电极反应式是:4OH-+4e-=2H2O+O2↑
(3)利用CO与H2反应可合成CH3OCH3.
已知:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g),△H=-247kJ/mol
在一定条件下的密闭容器中,该反应达到平衡,要提高CO的转化率,可以采取的措施是AE.
A.低温高压 B.加入催化剂 C.体积不变充入氦气D.增加CO的浓度 E.分离出二甲醚
(4)CH3OCH3也可由CH3OH合成.
已知反应2CH3OH(g)=CH3OCH3(g)+H2O(g),在某温度下,在1L密闭容器中加入CH3OH,反应到10分钟时达到平衡,此时测得各组分的浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.01 | 0.2 | 0.2 |
②该温度下的平衡常数为400.
③若平衡后,再向容器中再加入0.01mol CH3OH和0.2mol CH3OCH3,此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
 已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量. .
.