题目内容
3.下列表示HF、K2O形成过程的电子式正确的是( )①HF:
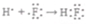 ②K2O
②K2O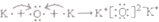
| A. | ①② | B. | ① | C. | ② | D. | 均不正确 |
分析 ①HF为共价化合物,分子中1个氢原子分别与1个F原子共用一对电子形成1个H-F键;
②氧化钾为离子化合物,电子式中必须标出阴阳离子所带电荷.
解答 解:①HF为共价化合物,分子中含有1个H-F键,用电子式表示其形成过程为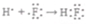 ,故①正确;
,故①正确;
②K2O为离子化合物,阴阳离子需要标出所带电荷,氧离子还需要标出最外层电子,用电子式表示其形成过程为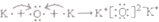 ,故②正确;
,故②正确;
故选A.
点评 本题考查了电子式的书写,题目难度中等,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式区别,试题培养了学生规范答题的能力.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
14.下列变化需要加入适当的氧化剂才能完成的是( )
| A. | H2SO4→CuSO4 | B. | MnO4-→Mn2+ | C. | Fe→FeCl3 | D. | NaNO3→N2 |
11.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| B. | 任何条件下,等物质的量的乙烯(C2H4)和一氧化碳所含的分子数必然相等 | |
| C. | 10g一氧化碳气体和10g氧气的体积相等 | |
| D. | 同温同压下,等体积的物质所含的分子数一定相等 |
8.下列过程涉及化学变化的是( )
| A. | 碘的升华 | B. | 石油分馏 | ||
| C. | 用苯萃取溴水中的溴 | D. | 煤的干馏 |
12.将一定量的Fe、Fe2O3 CuO的混合物放入体积为100mL、浓度为2.2mol•L-1的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28g.过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为l00mL).向滤液中滴加2mol•L-1NaOH 溶液,直至40mL时开始出现沉淀.则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为( )
| A. | 2mol•L-1 | B. | 1.8 mol•L-1 | C. | 1.4 mol•L-1 | D. | 无法计算 |
13.下列各组金属混合物的质量相同,它们分别与足量盐酸反应,在相同状况下产生的氢气体积也相同,则其中含铝的质量最少的是( )
| A. | 铁和铝 | B. | 锌和铝 | C. | 镁和铝 | D. | 铜和铝 |
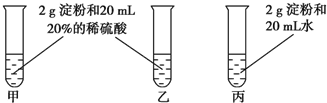 为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热.待试管甲中的溶液冷却后再进行后续实验.
为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热.待试管甲中的溶液冷却后再进行后续实验.