题目内容
15.由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图1转化关系(部分生成物和反应条件已略去).
(1)若A为金属钠,则E为H2,A与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑.
(2)若A为过氧化钠,则E为O2,A与水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑.
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是NaHCO3,
(4)向10ml某浓度的B溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有图2示两种情况(不计CO2的溶解),则曲线B表明M中的溶质为Na2CO3、NaHCO3;原NaOH溶液的物质的量浓度为0.75mol/L;由曲线A、B可知,两次实验通入的CO2的体积比为3:10.
分析 (1)若A为金属钠,A与水反应生成单质E为H2,则B为NaOH,C为Na2CO3,D为NaHCO3;
(2)若A为过氧化钠,A与水反应生成单质E为O2,则B为NaOH,C为Na2CO3,D为NaHCO3;
(3)根据(1)(2)可知D为碳酸氢钠;
(4)生成气体发生反应为:HCO3-+H+=H2O+CO2↑,假设溶液中溶质只有Na2CO3,开始没有气体生成时发生的反应为:H++CO32-=HCO3-,前后两过程消耗HCl的体积相等,由曲线A、B前后消耗盐酸的体积可知A中溶质为NaOH、Na2CO3,B中溶质为Na2CO3、NaHCO3;
生成气体最大时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl),进而计算NaOH的物质的量浓度;
曲线A生成二氧化碳消耗盐酸体积为(75-60)mL=15mL,曲线B生成二氧化碳消耗盐酸体积为(75-25)mL=50mL,由HCO3-+H+=H2O+CO2↑可求得两次实验通入的CO2的体积之比.
解答 解:(1)若A为金属钠,A与水反应生成单质E为H2,则B为NaOH,C为Na2CO3,D为NaHCO3,A与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,
故答案为:H2;2Na+2H2O=2Na++2OH-+H2↑;
(2)若A为过氧化钠,A与水反应生成单质E为O2,则B为NaOH,C为Na2CO3,D为NaHCO3,A与水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑,
故答案为:O2;2Na2O2+2H2O═4NaOH+O2↑;
(3)根据(1)(2)的分析可知,D为NaHCO3,
故答案为:NaHCO3;
(4)生成气体发生反应为:HCO3-+H+=H2O+CO2↑,假设溶液中溶质只有Na2CO3,开始没有气体生成时发生的反应为:H++CO32-=HCO3-,前后两过程消耗HCl的体积相等,而A曲线中实际开始阶段消耗盐酸体积大于产生二氧化碳消耗的盐酸体积,故A曲线表明M中的溶质为NaOH、Na2CO3,B曲线中,前后消耗盐酸的体积之比为1:3,则曲线B表明M中溶质为Na2CO3、NaHCO3,且二者物质的量之比为1:2,
当加入75mL盐酸时,溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.1mol/L×0.075L=0.0075mol,所以氢氧化钠的物质的量浓度为$\frac{0.0075mol}{0.01L}$=0.75mol/L,
曲线A生成二氧化碳消耗盐酸体积为(75-60)mL=15mL,曲线B生成二氧化碳消耗盐酸体积为(75-25)mL=50mL,由HCO3-+H+=H2O+CO2↑可知,则两次实验通入的CO2的体积之比=15mL:50mL=3:10,
故答案为:Na2CO3、NaHCO3;0.75mol/L;3:10.
点评 本题考查无机物推断、化学计算等,需要学生熟练掌握元素化合物知识,(4)中计算关键是根据图象判断溶液溶质的成分,题目难度中等.

①HF:
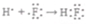 ②K2O
②K2O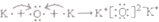
| A. | ①② | B. | ① | C. | ② | D. | 均不正确 |
| A. | 将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向硫酸铝铵[NH4Al(SO4)2]溶液中加入氢氧化钡溶液至SO42ˉ离子沉淀完全Al3++2SO42ˉ+2Ba2++4OHˉ═Al(OH)4ˉ+2BaSO4↓ | |
| D. | 向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+BaCO3↓ |
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 反应物的总能量比生成物的总能量大 | |
| C. | 氢氧化钠与盐酸的反应属于吸热反应 | |
| D. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
| A. | 氯元素在自然界中存在游离态,只是量极少 | |
| B. | 海水中的氯元素主要以NaCl等盐的形式存在 | |
| C. | 人体血液中含有NaCl,其浓度大约为0.9% | |
| D. | NaCl对维持人体的生理功能有着重要作用 |
| A. | Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应 | |
| B. | 纤维素与淀粉互为同分异构体 | |
| C. | 纤维素能够与醋酸发生酯化反应 | |
| D. | 实验室中Al(OH)3可以由可溶性铝盐和氨水制备 |
 .
.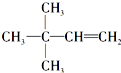 等.
等. .
.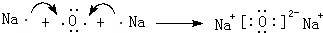 .
.